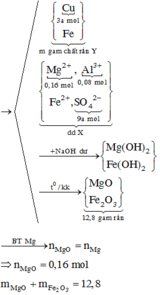
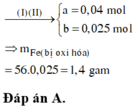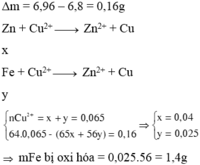Hỗn hợp A gồm Al và Fe có khối lượng 3,63g. Cho hỗn hợp A vào 200ml dung dịch CuSO4 0,2M; khuấy kĩ.Khi phản ứng xảy ra hoàn toàn được chất rắn B và dung dịch C. Chất rắn B gồm 2 kim loại , có khối lượng hơn khối lượng A là 0,89g .Tính khối lượng các chất trong hỗn hợp A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2 kim loại gồm Fe, Cu
\(n_{Al}=a;n_{Fe\left(pư\right)}=b;n_{Fe\left(dư\right)}=c\\ 27a+56\left(b+c\right)=8,3\\ n_{Cu}=0,2.1,05=0,21=1,5a+b\\ m_X=56c+64.0,21=15,68\\ a=0,1;b=0,06;c=0,04\\ \%m_{Al}=\dfrac{27a}{8,3}.100\%=32,53\%\\ \%m_{Fe}=67,47\%\)

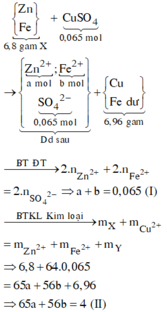
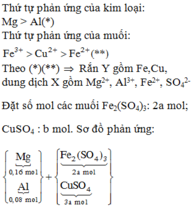
Δm = 6,96 – 6,8 = 0,16g
Zn + Cua2+ → Zn2+ + Cu
x
Fe + Cu2+ → Zn2+ + Cu
y
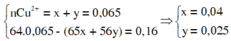
→ mFe bị oxi hóa = 0,025.56 = 1,4g
Đáp án A

giải em vs Đốt cháy hoàn toàn 0.3g hợp chất hữu cơ A thu được 0.224 dm3 khí CO2 ở đktc và 0.18g H2O. Lập công thức của A. vào câu hỏi của e trả lời e vs
công thức của hc là CxHyOz
khi dot chay
CxHyOz-------->CO2+H2O
x=1
y=4
z=1
---->CH4
---->cthh=COCO

n C u S O 4 = 0,525.0,2 = 0,105 m o l
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và C u , C u S O 4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
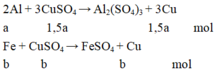
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
3 2 a + b = n C u S O 4 a .27 + b .56 + c .56 = m K L 3 2 a .64 + b .64 + c .56 = m k e t t u a ⇔ 3 2 a + b = 0,105 27 a + 56 b + 56 c = 4,15 96 a + 64 b + 56 c = 7,84
⇔ a = 0,05 b = 0,03 c = 0,02
Vậy n A l = 0 , 05 m o l ; n F e b đ = b + c = 0 , 05 m o l .
Đáp án C