Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Kết tủa A gồm 2 kim loại là Cu và Fe dư → CuSO4 và Al phản ứng hết.
n(CuSO4) = 0,525.0,2 = 0,105mol
Theo ĐL bảo toàn nguyên tố: n(Cu) = n(CuSO4) = 0,105mol
Khối lượng Fe dư:
m(Fe dư) = m(A) - m(Cu) = 7,84 - 0,105.64 = 1,12g
Gọi x, y là số mol Al và Fe tham gia pư:
m(hh KL) = m(Al) + m(Fe pư) + m(Fe dư) = 27x + 56y + 1,12 = 4,15g
Cho hh kim loại vài dung dịch CuSO4
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x 3x/2
Fe + CuSO4 → FeSO4 + Cu
y y
n(CuSO4) = 3x/2 + y = 0,105mol
→ x = 0,05mol và y = 0,03mol
Khối lượng mỗi kim loại:
m(Al) = 0,05.27 = 1,35g
m(Fe) = m(Fe pư) + m(Fe dư) = 56.0,03 + 1,12 = 2,8g
A chứa 2 kim loại là Cu và Fe dư →Al phản ứng hết,Fe phản ứng một phần ,Cu2 bị khử hết
Đặt a,b,c là số mol Al , Fe phản ứng và Fe dư
→ 27a + 56(b+c) = 4,15
bảo toàn electron → 3a + 2b = 0,105.2
mA= 56c + 0,105.64 = 7,84
Giả hệ → a=0,05 ; b=0,03 ; c=0,02
A gồm Cu (0,105)và Fe dư(0,02)
bảo toàn electron: 2ncu + 3nFe dư = 3nNO
→ nNO = 0,09
→ nHNO3 = 4nNO = 0,36 mol
→ V=180ml

Fe3O4+4CO=>3Fe+ 4CO2
CuO+CO=>Cu+CO2
Cr B gồm Fe Cu
HH khí D gồm CO dư và CO2
CO2 +Ca(OH)2=>CaCO3+H2O
p/100 mol<= p/100 mol
2CO2+Ca(OH)2 => Ca(HCO3)2
p/50 mol
Ca(HCO3)2+ 2NaOH=>CaCO3+ Na2CO3+2H2O
p/100 mol p/100 mol
Tổng nCO2=0,03p mol=nCO
=>BT klg
=>m+mCO=mCO2+mB=>mB=m+0,84p-1,32p=m-0,48p
c) hh B Fe+Cu
TH1: Fe hết Cu chưa pứ cr E gồm Ag Cu
dd Z gồm Fe(NO3)2
Fe+2Ag+ =>Fe2+ +2Ag
TH2:Cu pứ 1p cr E gồm Cu và Ag
Fe+2Ag+ => Fe2+ +2Ag
Cu+2Ag+ =>Cu2+ +2Ag
Dd Z gồm 2 muối của Fe2+ và Cu2+

n C u S O 4 = 0,525.0,2 = 0,105 m o l
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và C u , C u S O 4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
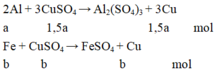
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
3 2 a + b = n C u S O 4 a .27 + b .56 + c .56 = m K L 3 2 a .64 + b .64 + c .56 = m k e t t u a ⇔ 3 2 a + b = 0,105 27 a + 56 b + 56 c = 4,15 96 a + 64 b + 56 c = 7,84
⇔ a = 0,05 b = 0,03 c = 0,02
Vậy n A l = 0 , 05 m o l ; n F e b đ = b + c = 0 , 05 m o l .
Đáp án C

\(M_{NO}=M_{C2H6}=30\rightarrow M_{Y'}=1,35.30=40,5,y=0,04mol\)
Gọi x,y là số mol của NO,N2O trong hh ta có hệ:
\(\begin{cases}30x+44y=0,04.40,5\\x+y=0,04\end{cases}\) \(\Rightarrow n_{NO}=x=0,01,n_{N2O}=0,03\)
Gọi a,b là số mol của Fe,R trong 3,3 gam hỗn hợp:
\(Fe+HCl\rightarrow FeCl_2+H_2\)
\(R+nHCl\rightarrow RCl_n+\frac{n}{2H2}\)
\(\Rightarrow56a+Rb=3,3\) (*)
\(\Rightarrow a+\frac{bn}{2}=0,12\) (**)
Hòa tan X trong HNO3
Quá trình oxi hóa
Fe →Fe3+ +3e
R→ Rn+ +ne
Quá trình khử:
NO3- +4H+ +3e → NO +2H2O
0,04 ← 0,03 ←0,01
NO3- +8H+ +8e → N2O +2H2O
0,3 ← 0,24 ←0,03
Áp dụng bảo toàn electron ta có
3a+ nb =0,27 (3)
Từ 2,3 → a=0,03 ,nb=0,18 thay vào 1 ta có: R=9n → n=3,R=27 → là Al
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
nHNO3du =0,01.0,34=0,034 mol=nH+ dư
cho NaOH vào Z
H+ + OH- → H2O
0,034→0,034
Fe3+ + 3OH- → Fe(OH)3
0,03→0,09→0,03
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- →AlO2- + 2H2O
Vì Fe(OH)3 kết tủa hết → nAl(OH)3 =(4,77-3,21)/78=0,02 mol < nAl3+ =0,06 mol → có 2 trường hợp
TH1 : Al3+ dư → nNaOH =0,034 +0,09 +0,06 =0,184 mol → CM(NaOH)=0,184/0,4=0,46M
TH2: Al3+ hết → nNaOH =0,034 +0,09 +0,18 +0,04 =0,344 mol → CM(NaOH)=0,344/0,4=0,86M

Cho hỗn hợp X vào dung dịch HCl lấy dư:
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2
Dung dịch Y gồm: AlCl3, MgCl2, FeCl2, HCl dư
Khí Z là H2
Chất rắn A là Cu
Cho A tác dụng với H2SO4 đặc nóng.
PTHH: Cu + 2H2SO4(đặc, nóng) → CuSO4 + SO2 + 2H2O
Khí B là SO2
Cho B vào nước vôi trong lấy dư
PTHH: SO2 + Ca(OH)2 → CaSO3 + H2O
Kết tủa D là CaSO3
Cho dung dịch NaOH vào Y tới khi kết tủa lớn nhất thì dừng lại.
PTHH: NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Chất rắn E là: Al(OH)3, Mg(OH)2, Fe(OH)2
Nung E trong không khí
Chất rắn G là Al2O3, MgO, Fe2O3

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)



SAO KO AI TRL HẾT Z