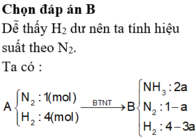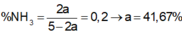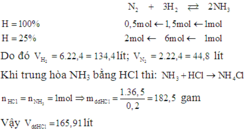Từ 2m3 (đktc) hỗn hợp N2 và H2 (có tỉ lệ thể tích là 1:3) thu được một lượng NH3 đủ để pha chế 3,914 lit dung dịch NH3 20% (d=0,923g/ml). Tính hiệu suất quá trình tổng hợp NH3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giả sử nN2 = 1mol ⇒ nH2 = 4 mol
N2 + 3H2 → 2NH3
a 3a 2a
Thể tích khí sau phản ứng là: 5 – 4a + 2a = 5 – 2a
B có 20% NH3 theo thể tích ⇒ 2a : (5 – 2a) = 0,2
⇒ a = 0,4167 ⇒ H = 41,67%
Đáp án C.

PT: \(N_2+3H_2\underrightarrow{t^o}2NH_3\)
VN2 : VH2 = 1:3
VN2 + VH2 = 10
⇒ VN2 = 2,5 m3, VH2 = 7,5 m3
Ở cùng điều kiện nhiệt độ áp suất, tỉ lệ số mol cũng là tỉ lệ thể tích.
Theo PT: \(V_{NH_3\left(LT\right)}=2V_{H_2}=5\left(m^3\right)\)
Mà: H = 95% ⇒ VNH3 (TT) = 5.95% = 4,75 (m3)

\(N_2+3H_2\leftrightarrow2NH_3\)
ban đầu: 1 mol 3 mol
phản ứng: a → 3a → 2a
dư: 1 – a 3 – 3a 2a
=> n hỗn hợp sau phản ứng = 1–a+3–3a+2a = 4 – 2a
n hỗn hợp trước phản ứng = 1 + 3 = 4 mol
Bảo toàn khối lượng:
m trước = m sau => Mt.n t = Ms.ns
\(\Rightarrow\dfrac{M_t}{M_s}=\dfrac{n_s}{n_t}\Rightarrow\dfrac{4-2a}{4}=0,6\\ \Rightarrow a=0,8\\ \Rightarrow H=\dfrac{0,8}{1}\cdot100\%=80\%\)