Cho m gam kim loại Cu tác dụng vừa đủ với 5,6 lít đơn chất halogen (ở đktc) thì thu được 33,75 gam muối. Xác định TÊN halogen đó
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
Gọi đơn chất halogen là X2
\(Cu+X_2\underrightarrow{^{to}}CuX_2\)
Ta có:
\(n_X=\frac{5,6}{22,4}=0,25\left(mol\right)=n_{CuX2}\)
\(\Rightarrow M_{CuX2}=64+2X=\frac{33,75}{0,25}=135\)
\(\Rightarrow X=35,5\left(Clo\right)\)
Halogen là Cl2 - Clo
Câu 2:
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
_______0,15__0,3___0,15___0,15__
\(n_{Fe}=\frac{8,4}{56}=0,15\left(mol\right)\)
a,\(V_{H2}=0,15.22,4=3,36\left(l\right)\)
b, \(CM_{HCl}=\frac{0,3}{0,2}=1,5M\)

Bảo toàn khối lượng ta có: $m_{R}=2,4(g)$$R+X_2\rightarrow RX_2$
Ta có: $\frac{2,4}{R}=\frac{4,26}{2X}$
Lập bảng biện luận thông qua halogen tìm được X và R lần lượt là Cl và Ca

\(m_{HX}=\dfrac{10,95.200}{100}=21,9\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HX --> 2AlX3 + 3H2
0,2--->0,6-------------->0,3
=> \(M_{HX}=\dfrac{21,9}{0,6}=36,5\left(g/mol\right)\)
=> X là Cl
VH2 = 0,3.22,4 = 6,72(l)

1.
Gọi hóa trị của kim loại M là n, ta có:
\(2M+nCl_2\underrightarrow{^{to}}2MCl_n\)
Dựa vào pt, ta thấy:
nM=nMCln
⇔ 3,2/M=6,75/M+35,5n
⇔ M=32n
Vì M là kim loại nên hóa trị có thể là I, II và III:
- Nếu n=1 ==> M=32 (Loại)
- Nếu n=2 ==> M=64 (Chọn - Cu)
- Nếu n=3 ==> M=96 (Loại)
Vậy kim loại M là Cu.
2.
\(Cu+X_2\underrightarrow{^{to}}CuX_2\)
nX2=2,24/22,4=0,1 (mol)
nCuX2=nX2=0,1 (mol)
==> mCuX2= 0,1.(64 + 2X)=22,4
==> X= 80 (Br)
Vậy halogen X là Br.

1)
CTHH MXn
\(n_{X_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
=> \(n_{MX_n}=\dfrac{0,08}{n}\left(mol\right)\)
=> \(n_{AgX}=0,08\left(mol\right)\)
=> \(M_{AgX}=\dfrac{11,48}{0,08}=143,5\left(g/mol\right)\) => MX = 35,5 (g/mol)
=> X là Cl
2)
\(n_{MCl_n}=\dfrac{0,08}{n}\left(mol\right)\)
\(n_M=\dfrac{0,96}{M_M}\left(mol\right)\)
=> \(\dfrac{0,08}{n}=\dfrac{0,96}{M_M}\)
=> MM = 12n (g/mol)
Xét n = 1 => Loại
Xét n = 2 => MM = 24 (g/mol) => M là Mg
Xét n = 3 => Loại
Vậy M là Mg
M' có hóa trị II
\(n_{O_2}=\dfrac{4,162-0,96-2,242}{32}=0,03\left(mol\right)\)
PTHH: 2Mg + O2 --to--> 2MgO
0,04-->0,02------>0,04
2M' + O2 --to--> 2M'O
0,02<-0,01------>0,02
=> MM' = \(\dfrac{2,242}{0,02}=112\left(g/mol\right)\)
a) \(\left\{{}\begin{matrix}\%n_M=\dfrac{0,04}{0,04+0,02}.100\%=66,67\%\\\%n_{M^{\cdot}}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
b) \(\dfrac{M_M}{M_{M^{\cdot}}}=\dfrac{24}{112}=\dfrac{3}{14}\)
c) \(n_O=0,06\left(mol\right)\)
=> \(n_{H_2O}=0,06\left(mol\right)\)
=> \(n_{H_2SO_4}=0,06\left(mol\right)\)
=> \(C_{M\left(H_2SO_4\right)}=\dfrac{0,06}{0,5}=0,12M\)

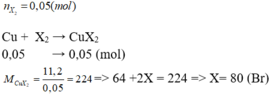
Gọi halogen đó là X , CTTQ: CuX2
\(PTHH:Cu+X_2\underrightarrow{^{to}}CuX_2\)
Áp dụng ĐLTL ta có:
\(\Leftrightarrow\frac{22,4}{5,6}=\frac{64+2X}{33,75}\)
\(\Rightarrow x=35,5\left(Clo\right)\)
Vậy halogen là Clo ( Clo )