Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi halogen đó là X , CTTQ: CuX2
\(PTHH:Cu+X_2\underrightarrow{^{to}}CuX_2\)
Áp dụng ĐLTL ta có:
\(\Leftrightarrow\frac{22,4}{5,6}=\frac{64+2X}{33,75}\)
\(\Rightarrow x=35,5\left(Clo\right)\)
Vậy halogen là Clo ( Clo )

1. Gọi n là số mol của R và RO
nHCl = 0.4*1 = 0.4 mol
PTHH: R + 2 HCl -------> RCl2 + H2
x .................... 2x
RO + 2 HCl -> RCl2 + H2O
x ......... 2x
Ta có: 2x + 2x = 0,4 => x = 0,1
Thay x=0.1 vào Rx + (R+16)x = 6,4
<=> 0,2.R + 16.0,1 = 6,4
=> R = 24(Mg)
Vậy R là Magie và oxit là MgO.
2. Gọi n là số mol của halogen X cần tìm
PTHH : Mg +X2 ------> MgX2
n..........n................n
2Al + 3X2 --------> 2AlX3
\(\dfrac{2}{3}n\) .......n....................\(\dfrac{2}{3}n\)
Ta có: \(\left\{{}\begin{matrix}\left(24+2X\right)n=19\\\left(27+3X\right)\cdot\dfrac{2}{3}n=17.8\end{matrix}\right.\) <=> \(\left\{{}\begin{matrix}24n+2Xn=19\\18n+2Xn=17.8\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}n=0.2\\X=35.5\left(Clo\right)\end{matrix}\right.\)
Vậy halogen X cần tìm là Clo

Ta có: \(n_{H_2}=\dfrac{0,224}{22,4}=0,01\left(mol\right)\)
BT e, có: 2nR = 2nH2 ⇒ nR = 0,01 (mol)
\(\Rightarrow M_R=\dfrac{1,37}{0,01}=137\left(g/mol\right)\)
→ R là Ba.
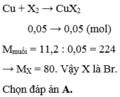




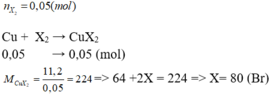
Bảo toàn khối lượng ta có: $m_{R}=2,4(g)$$R+X_2\rightarrow RX_2$
Ta có: $\frac{2,4}{R}=\frac{4,26}{2X}$
Lập bảng biện luận thông qua halogen tìm được X và R lần lượt là Cl và Ca
À tức là vì ở đây halogen chỉ có 4 là F2; Cl2; Br2 và I2 nên nó bị giới hạn rõ hơn nên mình lấy nó làm mốc để tìm ra R nhé!