Cho 200g dung dịch BaCl2 20,8% tác dụng với 150g dung dịch Na2SO4 28,4%. Tính C% các chất thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
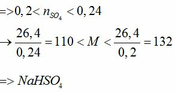
b)
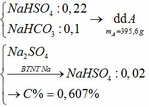
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

a, \(Na_2O+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
b, Số mol \(H_2SO_4\) là: \(n_1=V.C_M=0,5.0,5=0,25\) (mol)
Số mol \(Na_2SO_4\) là \(n_2=\dfrac{28,4}{142}=0,2\) (mol)
Do \(n_2< n_1\) nên \(H_2SO_4\) còn dư
Suy ra số mol \(Na_2O\) tham gia phản ứng là: \(n=n_2=0,2\) (mol)
Khối lượng là: \(m_{Na_2O}=0,2.62=12,4g\)

\(n_{BaCl_2}=\dfrac{150.16,64\%}{137+35.2}=0,12\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{100.14,7\%}{98}=0,15\left(mol\right)\)
Phương trình hóa học :
BaCl2 + H2SO4 -----> BaSO4 + 2HCl
Dễ thấy \(\dfrac{n_{BaCl_2}}{1}< \dfrac{n_{H_2SO_4}}{1}\Rightarrow H_2SO_4\text{ dư }0,15-0,12=0,03\left(mol\right)\)
c) Khối lượng kết tủa :
\(m_{BaSO_4}=0,12.233=27,96\) (g)
Khối lượng chất tan : \(m_{HCl}=0,24.36,5=8,76\left(g\right)\) ;
\(m_{H_2SO_4\left(\text{dư}\right)}=0,03.98=2,94\left(g\right)\)
c) \(C\%_{H_2SO_4}\)= \(\dfrac{2,94}{150+100}.100\%=1,176\%\)
\(C\%_{HCl}=\dfrac{8,76}{150+100}.100\%=3.504\%\)
d) NaOH + HCl ---> NaCl + H2O
0,24 <-- 0,24
mol mol
2NaOH + H2SO4 ---> Na2SO4 + 2H2O
0,06 mol <-- 0,03 mol
\(\Rightarrow n_{NaOH}=0,24+0,06=0,3\left(mol\right)\)
\(V_{NaOH}=0,3.2=0,6\left(l\right)\)

\(n_{Na_2SO_4}=\dfrac{71.20}{100.142}=0,1\left(mol\right)\)
\(n_{BaCl_2}=\dfrac{100.10,4}{100.208}=0,05\left(mol\right)\)
PTHH: \(Na_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2NaCl\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\) => BaCl2 hết, Na2SO4 dư
PTHH: \(Na_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2NaCl\)
0,05<--------0,05---->0,05------->0,1
=> \(\left\{{}\begin{matrix}m_{Na_2SO_4}=\left(0,1-0,05\right).142=7,1\left(g\right)\\m_{NaCl}=0,1.58,5=5,85\left(g\right)\end{matrix}\right.\)
mdd sau pư = 71 + 100 - 0,05.233 = 159,35(g)
=> \(\left\{{}\begin{matrix}C\%\left(Na_2SO_4\right)=\dfrac{7,1}{159,35}.100\%=4,456\%\\C\%\left(NaCl\right)=\dfrac{5,85}{159,35}.100\%=3,67\%\end{matrix}\right.\)

Ta có
\(m_{BaCl_2}=\frac{200.20,8}{100}=41,6\left(g\right)\Rightarrow n_{BaCl_2}=\frac{41,6}{208}=0,2\left(mol\right)\)
\(m_{Na_2SO_4}=\frac{150.28,4}{100}=42,6\left(g\right)\Rightarrow n_{Na_2SO_4}=\frac{42,6}{142}=0,3\left(mol\right)\)
\(BaCl_2+Na_2SO_4\rightarrow BaSO_4\downarrow+2NaCl\)
Thấy \(n_{BaCl_2}< n_{Na_2SO_4}\Rightarrow\) Tính theo \(BaCl_2\)
\(m_{ddsaupu}=200+150=350\left(g\right)\)
Có \(n_{NaCl}=2n_{BaCl_2}=0,4\left(mol\right)\)
\(\Rightarrow m_{NaCl}=58,5.0,4=23,4\left(g\right)\Rightarrow C\%\left(NaCl\right)=\frac{23,4}{350}.100\%\approx6,67\%\)
BaCl2 + Na2SO4-----> BaSO4 +2 NaCl
Ta có
m\(_{BaCl2}=\)\(\frac{200.20,8}{100}=41,6\left(g\right)\)
n\(_{BaCl2}=\frac{41,6}{110}=0,38\left(mol\right)\)
m\(_{Na2SO4}=\frac{150.28,4}{100}=42,6\left(g\right)\)
n\(_{Na2SO4}=\frac{42,6}{142}=0,3\left(mol\right)\)
=> BaCl2 dư
Theo pthh
n\(_{BaCl2}=n_{Na2SO4}=0,3\left(Mol\right)\)
n\(_{BaCl2}dư=0,38-0,3=0,08\left(mol\right)\)
mdd= 200+150=350(g)
C%(BaCl2)=\(\frac{0,08.110}{350}.100\%=2,5\%\)
Theo pthh
n\(_{NaCl}=2n_{Na2SO4}=0,6\left(mol\right)\)
C%(NaCl)=\(\frac{0,6.58,5}{350}.100\%=10\%\)
Chúc bạn học tốt