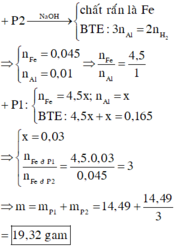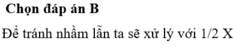Hỗn hợp X gồm C2H5OH,CH3COOH chia X thành 2 phần bằng nhau. phần 1 phản ứng với K dư thì thấy giải phóng 8,96 lít khí (đktc). Để trung hòa hết phần 2 phải dùng 150 g dung dịch NaOH 8%.
1. Tiến hành phản ứng este hóa thì được bao nhiêu g este, biết H=65%
2. Tính thể tích O2(đktc) cần lấy để đốt cháy hết X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Phản ứng: 8 Al + 3 Fe 3 O 4 → t o 4 Al 2 O 3 + 9 Fe
Vì phần 1 tác dụng với dung dịch NaOH có xuất hiện khí nên trong hỗn hợp có Al dư sau phản ứng. Do đó sau phản ứng, ta thu được hỗn hợp gồm Al, Fe và Al2O3.
Vì khối lượng hai phần bằng nhau nên số mol mỗi chất trong mỗi phần cũng bằng nhau.
Phần 1 tác dụng với dung dịch NaOH có:
n Al = 2 3 n H 2 = 0 , 75 ( mol )
Phần 2 tác dụng với dung dịch HNO3 có:
n NO 2 = 3 n Al + 3 n Fe ⇒ n Fe = n NO 2 - 3 n Al 3 = 0 , 1
Do đó tổng khối lượng hai phân có nF =2.0,1 = 0,2 (mol)
Vậy mFe =0,2.56 = 11,2 (gam)

Đáp án A
2 Al + Fe 2 O 3 → t o Al 2 O 3 + 2 Fe
Vì chia hỗn hợp Y thành hai phần bằng nhau nên số mol mỗi chất trong hai phần đều bằng nhau.
Vì phần 1 tác dụng với dung dịch NaOH có xuất hiện khí nên Y có Al.
Do đó Y có Al, Fe, A12O3 và có thể có Fe2O3.


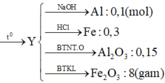
Đáp án C
Đặt nAl = x; nNa = y ; nFe = z (mol)
P2 tác dụng với NaOH dư cho nhiều khí hơn P1
=>P1 Al chưa tan hết.
Ta có: mhh = 27x + 23y + 56z = 39,9
n khí P1 = y 2 + 3 y 2 = 0 , 2
n khí P2 = y 2 + 3 x 2 = 0 , 35
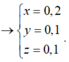
Vậy nếu t/d với dung dịch HCl thì ånkhí =
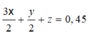
V = 0,45.22,4 = 10,08 lít