Cho V (1) CO2 đkc vào 300ml dd Ca(OH)2 1M sau phản ứng thu được 25g kết tủa . V bằng ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sục V lít CO2 vào 300ml dd X gồm NaOH 1M và Ca(OH)2 1M, sau phản ứng thu được 98,5g kết tủa. Tính V.


Bài 23 :
n BaCO3 = 0,1(mol) > n Ba(OH)2 = 0,15 mol
- TH1 : Ba(OH)2 dư
$Ba(OH)_2 + CO_2 \to BaCO_3 + H_2O$
n CO2 = n BaCO3 = 0,1(mol)
=> V = 0,1.22,4 = 2,24 lít
- TH1 : BaCO3 bị hòa tan một phần
$Ba(OH)_2 + CO_2 \to BaCO_3 + H_2O(1)$
$Ba(OH)_2 + 2CO_2 \to Ba(HCO_3)_2(2)$
n CO2(1) = n Ba(OH)2 (1) = n BaCO3 = 0,1(mol)
=> n Ba(OH)2 (2) = 0,15 - 0,1 = 0,05(mol)
=> n CO2 (2) = 2n Ba(OH)2 (2) = 0,1(mol)
=> V = (0,1 + 0,1).22,4 = 4,48 lít

\(n_{Ba\left(OH\right)_2}=0,15.1=0,15\left(mol\right)\)
Vì phản ứng tạo kết tủa nên xét 2 trường hợp:
TH1: Ba(OH)2 dư, phản ứng tạo muối trung hoà
\(PTHH:Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
\(n_{CO_2}=n_{BaCO_3}=\dfrac{19,7}{137+12+3.16}=0,1\left(mol\right)\)
\(V=0,1.22,4=2,24\left(l\right)\)
TH2: Ba(OH)2 dư, phản ứng tạo 2 muối.
\(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\left(1\right)\\ 2CO_2+Ba\left(OH\right)_2\rightarrow Ba\left(HCO_3\right)_2\left(2\right)\)
\(\left(1\right)\Rightarrow n_{Ba\left(OH\right)_2\left(1\right)}=0,1\left(mol\right)\\ \Rightarrow n_{Ba\left(OH\right)_2\left(2\right)}=0,15-0,1=0,05\left(mol\right)\\ \Rightarrow n_{CO_2}=0,1+0,05.2=0,2\left(mol\right)\\ V=0,2.22,4=4,48\left(l\right)\)

Đáp án B
Ta có :
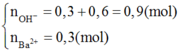
Vì cho BaCl2 vào X có kết tủa nên X có dư
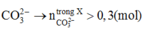
Tất nhiên ta có thể thử đáp án. Tuy nhiên, tôi sẽ biện luận với 2 trường hợp có thể xảy ra với X vẫn thỏa mãn đầu bài là :
+ Nếu X chỉ chứa
![]()
![]()
+ Nếu X chứa
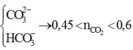
![]()



| CHÚ Ý |
| Với bài toán sục khí CO2 vào dung dịch kiềm. Nếu quá trình tạo muối có sinh ra dưới dạng muối tan và kết tủa. Ví dụ như BaCO3 và Na2CO3 thì khi tiếp tục sục khí CO2 vào thì Na2CO3 sẽ phản ứng với CO2 trước. Khi hết Na2CO3 rồi thì kết tủa BaCCO3 mới bị hòa tan. |

Vì sau khi lọc bỏ kết tủa, cho dd NaOH lại xuất hiện kết tủa
\(\Rightarrow\) Phản ứng tạo ra dd Ca(HCO3)2
Đặt \(n_{CaCO_3}=a\left(mol\right);n_{Ca\left(HCO_3\right)_2}=b\left(mol\right)\)
\(PTHH:Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
(mol)_________a______a_________a_______
\(PTHH:Ca\left(OH\right)_2+2CO_2\rightarrow Ca\left(HCO_3\right)_2\)
(mol)_______b_________2b_________b_
Theo đề ta có hpt:
\(\left\{{}\begin{matrix}a+b=0,2.1\\100a=15\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,15\\b=0,05\end{matrix}\right.\)
\(V_{CO_2}=22,4.\left(a+2b\right)=22,4.\left(0,15+0,05.2\right)=5,6\left(l\right)\)

nCa(OH)2= 0,2.1 = 0,2 mol.
nCaCO3 = 15 : 100 = 0,15mol
Cho NaOH vào dung dịch sau PƯ thấy xuất hiện kết tủa nên trong dd có muối Ca(HCO3)2
Vậy xảy ra 2 phản ứng:
CO2 + Ca(OH)2 -----> CaCO3 + H2O (1)
0,15 mol 0,15 mol 0,15 mol
2CO2 + Ca(OH)2 ------> Ca(HCO3)2 (2)
2. 0,05 mol 0,05 mol
Theo (1) : nCO2(1) = nCa(OH)2 (1) = nCaCO3 = 0,15mol
=> nCa(OH)2 (2) = 0,2 - 0,15 = 0,05 mol
Theo (2) : nCO2 (2) = 2. 0,05 = 0,1 mol
=> nCO2 = 0,15 + 0,1 = 0,25 mol
=> VCO2 = 0,25 . 22,4 = 5,6 (L)
nCaCO3 = 10 / 100 = 0,1 chứ ạ !!
vì m kết tủa bằng 10 chứ ạ ???? giải thích hộ vs ạ

\(a,Ca(OH)_2+2HCl\to CaCl_2+2H_2O\\ b,n_{HCl}=1.0,3=0,3(mol)\\ \Rightarrow n_{Ca(OH)_2}=n_{CaCl_2}=0,15(mol)\\ \Rightarrow V_{dd_{Ca(OH)_2}}=\dfrac{0,15}{0,5}=0,3(l)\\ \Rightarrow C_{M_{CaCl_2}}=\dfrac{0,15}{0,3+0,3}=0,25M\)
CO2 + Ca(OH)2 => CaCO3 + H2O (1)
nCaCO3 = m/M = 25/100 = 0.25 (mol)
nCa(OH)2 = CM.V = 0.3 (mol) > 0.25
Có 2 thường hợp:
TH1: ==> 2 pứ xảy ra
2CO2 + Ca(OH)2 => Ca(HCO3)2 (2)
Theo pt ==> nCO2 (1) =nCaCO3 = 0.25 (mol)
nCO2 (2) = (0.3 - 0.25)x2 = 0.1 (mol)
nCO2 = 0.25 + 0.1 = 0.35 (mol) => V = 22.4xn = 22.4 x 0.35 = 7.84 (l)
TH2: Chỉ có 1 pứ trung hòa xảy ra: Ca(OH)2 dư
nCO2 = 0.25 (mol) => V = 22.4 x 0.25 = 5.6 (l)
\(n_{Ca\left(OH\right)_2}=0,3.1=0.03\left(mol\right)\)
\(n_{CaCO3}=\frac{25}{100}=0.25\left(mol\right)\)
TH1: Chỉ tạo ra muối CaCO3
\(n_{CO2}=n_{CaCO3}=0,25\left(mol\right)\)
\(V_{CO_2}=0,25.22,4=5.6\left(l\right)\)
TH2: Tạo ra cả hai muối
\(Ca\left(OH\right)_2+CO_{2_{ }}\rightarrow CaCO3+H_2O\)
\(Ca\left(OH\right)_2+2CO2\rightarrow Ca\left(HCO3\right)_2\)
\(n_{Ca\left(OH\right)_2\left(1\right)}=n_{CO_2\left(1\right)}=n_{CaCO3}=0,25\left(mol\right)\)
\(n_{CO_2}=2n_{Ca\left(OH\right)_2\left(2\right)}=\left(0,3-0,25\right)=0,1\left(mol\right)\)
\(\sum n_{CO_2}=0,25+0,1=0,35\left(mol\right)\)
\(V_{CO_2}=0,35.22,4=7,84\left(l\right)\)