Một ống sứ chứa 4,72 gam một hỗn hợp A gồm 3 chất là Fe,FeO,Fe2O3. Nung nóng ống ở nhiệt độ cao rồi cho một dòng khí hiđrô đi qua . Dẫn khí tạo thành sau pư đi qua bình đựng dung dịch axit sunfuric đặc . Sau khi pư kết thúc khối lượng của bình đựng axit sunfuric tăng thêm 0,9 gam. Nếu cũng lấy 4,92 gam A cho tác dụng với dung dịch HCl 1M dư thì thu được 0,672 lít khí hiđrô (đktc).
a) Tính khối lượng mỗi chất trong hỗn hợp A
b)Tính thể tích dung dịch axit HCl 1M tối thiểu để hoà tan hoàn toàn hỗn hợp A .
Cảm ơn mọi người đã giúp !


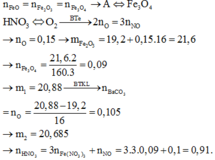
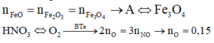
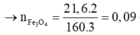
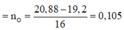
4,72 gam hỗn hợp A: \(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\FeO:b\left(mol\right)\\Fe_2O_3:c\left(mol\right)\end{matrix}\right.\)\(\underrightarrow{H_2,t^o}\)\(\left\{{}\begin{matrix}Fe\\H_2O:0,05\left(mol\right)\end{matrix}\right.\)
4,92 gam hỗn hợp A: \(\left\{{}\begin{matrix}Fe:ka\left(mol\right)\\FeO:kb\left(mol\right)\\Fe_2O_3:kc\left(mol\right)\end{matrix}\right.\)\(\underrightarrow{HCl\left(dư\right)}\)\(H_2:0,03\left(mol\right)\)
\(FeO\left(b\right)+H_2-t^o->Fe+H_2O\left(b\right)\)
\(Fe_2O_3\left(c\right)+3H_2-t^o->2Fe+3H_2O\left(3c\right)\)
Ta có: \(56a+72b+160c=4,72\left(I\right)\)
và \(b+3c=0,05\left(II\right)\)
Gọi k là số lần gấp của số mol hh sau so với bđ
\(\Rightarrow56ka+72kb+160kc=4,92\)
\(\Rightarrow k=\dfrac{4,82}{56a+72b+160c}\left(III\right)\)
\(Fe\left(ka\right)+2HCl\rightarrow FeCl_2+H_2\left(ka\right)\)
\(\Rightarrow ka=0,03\)
\(\Rightarrow k=\dfrac{0,03}{a}\left(IV\right)\)
Từ (III) và (IV) \(\Rightarrow\dfrac{4,92}{56a+72b+160c}=\dfrac{0,03}{a}\)
\(\Leftrightarrow-3,24a+2,16b+4,8c=0\left(V\right)\)
Từ (I) , (II) và (V) => số mol và khối lượng mỗi chất.
Câu b chỉ việc suy ra số mol => tính được thể tích dung dịch
@Nguyễn Xuân Dương
Khí hơi thu được sau thí nghiệm 1 là H2O
Dẫn qua bình H2SO4 đặc => H2O bị giữ lại trong bình
=> Khối lượng bình tăng = khối lượng nước bị hấp thụ vào
=> mH2O = 0,9 (g) = 0,05 (mol)
Ở thí nghiệm 2: Cho hỗn hợp A tác dụng với dung dịch HCl dư
=> Fe + HCl tạo ra khí là H2
nH2 = 0,672/22,4 = 0,03 (mol)