Một hh X có thể tích 17,92 gồm H2 và C2H2 có tỉ khối so với N2 là 0,5. Đốt hhk X với 35,84 l khí oxi. Phản ứng xong, làm lạnh để hơi nước ngưng tụ hết thu được hỗn hợp khí Y. (đktc). Hãy xác định % V,m của Y.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1 :
Giả sử : hỗn hợp có 1 mol
\(n_{H_2}=a\left(mol\right),n_{O_2}=1-a\left(mol\right)\)
\(\overline{M_X}=0.3276\cdot29=9.5\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow m_X=2a+32\cdot\left(1-a\right)=9.5\left(g\right)\)
\(\Rightarrow a=0.75\)
Cách 1 :
\(\%H_2=\dfrac{0.75}{1}\cdot100\%=75\%\)
\(\%O_2=100-75=25\%\)
Cách 2 em tính theo thể tích nhé !

Đáp án B
Theo giả thiết, bảo toàn nguyên tố C và bảo toàn electron, ta có :

MY= 24,4 → Y chứa H2. Khí không màu hóa nâu ngoài không khí là NO → Y chứa NO và H2.
Gọi x và y lần lượt là số mol của H2 và NO
Ta có: x+ y= 0,125; 2x+ 30y= 0,125.24,4 → x= 0,025; y= 0,1
Vì có khí H2 thoát ra và Zn dư → H+ và NO3- hết → Muối thu được là muối clorua
Do nNO3(-)ban đầu= 0,15 mol > nNO= 0,1 mol→ X chứa NH4+
Theo bảo toàn nguyên tố N → nNH4+= 0,15-0,1= 0,05 mol
Theo bảo toàn electron: 2.nZn pứ= 3.nNO+ 8nNH4++ 2nH2= 0,75 mol→ nZn pứ= nZn2+= 0,375 mol
→mmuối= mZnCl2+ mNH4Cl+ mNaCl+ mKCl= 136. 0,375+ 53,5.0,05+ 58,5.0,05+ 74,5.0,1= 64,05 gam
Đáp án A

khối lượng của X =55g
tổng số mol X =2,9 mol
sau phản ứng khối lượng Z=khối lượng X=55 g
suy ra số mol Z=1,9 mol
số mol khí giảm là số mol H2 pư
trong X có số mol liên kết pi =2 mol
số mol liên kết pi mất đi=số mol H2=1mol
vậy số mol liên kết pi còn lại là 1 mol
trong 1/10 Z có 0,1 mol liên kết pi
số mol Br2 pư=0,1 mol => V=1 lít
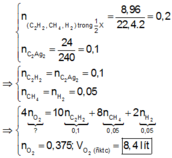
giả sử kết tủa chỉ có BaSO4 => mBaSO4 =0,15 .233 =34,95 < 49,725 => kết tủa gồm BaCO3 và BaSO4
giả sử trong dd X chỉ có muối CO3 2- => nH+ = 0,3 .2 =0,6 > 0,525 => loại
trong dd X chỉ có HCO3- => nH+ = 0,3 => loại
vậy trong X có cả 2 muối trên
mBaCO3 =m kết tủa - mBaSO4 => nBaCO3 = 0,075
nCO2 =0,075 + 0,3 =0,375 => V=8,4

khối lượng của X =55g
tổng số mol X =2,9 mol
sau phản ứng khối lượng Z=khối lượng X=55 g
suy ra số mol Z=1,9 mol
số mol khí giảm là số mol H2 pư
trong X có số mol liên kết pi =2 mol
số mol liên kết pi mất đi=số mol H2=1mol
vậy số mol liên kết pi còn lại là 1 mol
trong 1/10 Z có 0,1 mol liên kết pi
số mol Br2 pư=0,1 mol => V=1 lít
khối lượng của X =55g
tổng số mol X =2,9 mol
sau phản ứng khối lượng Z=khối lượng X=55 g
suy ra số mol Z=1,9 mol
số mol khí giảm là số mol H2 pư
trong X có số mol liên kết pi =2 mol
số mol liên kết pi mất đi=số mol H2=1mol
vậy số mol liên kết pi còn lại là 1 mol
trong 1/10 Z có 0,1 mol liên kết pi
số mol Br2 pư=0,1 mol => V=1 lít
Gọi \(n_{H2}=x\left(mol\right)\), \(n_{C2H2}=y\left(mol\right)\)
Ta có: \(n_X=x+y=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)(1)
\(d_X\)/N2 =0,5\(\Rightarrow M_X=0,5\cdot28=14\left(g\right)\)
Mà \(M_X=\dfrac{m_X}{n_X}=\dfrac{2x+26y}{0,5}=14\)
\(\Rightarrow2x+26y=14\cdot0,8=11,2\left(g\right)\)(2)
Từ(1),(2)\(\Rightarrow\left\{{}\begin{matrix}2x+26y=11,2\\x+y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,4\left(mol\right)\\y=0,4\left(mol\right)\end{matrix}\right.\)
PTHH:\(2C_2H_2+O_2\rightarrow4CO_2+2H_2O\)
0,4 1 (mol)
\(2H_2+O_2\rightarrow2H_2O\)
0,4 0,2 (mol)
Theo PTHH(1),(2): \(n_{O2}\)p/ứ = 1+0,2=1,2(mol)
Theo bài ra: nO2 p/ứ =\(\dfrac{35,84}{22,4}=1,6\left(mol\right)\)
=> nO2 dư =1,6-1,2=0,4(mol)
=> Trong Y gồm CO2 và O2 dư
Theo PTHH(1):\(n_{CO2}=2.n_{C2H2}2\cdot0,4=0,8\left(mol\right)\)
Mà % về thể tích cũng là % về số mol nên:
\(\Rightarrow\%V_{O2}=\dfrac{0,4}{0,4+0,8}\cdot100\%\approx33,33\%\)
\(\%V_{CO2}=100\%-33,33\%=66,67\%\)
\(\Rightarrow\%m_{O2}=\dfrac{0,4\cdot32}{0,4\cdot32+0,8\cdot44}\cdot100\%\approx26,7\%\)
\(\%m_{CO2}=100\%-26,7\%=73,3\%\)