Trên hai đĩa cân để hai cốc đựng dung dịch axit clohidric và axit sunfuric, cân ở vị trí thăng bằng.
- Cho vào cốc đựng dung dịch axit clohidric 25 gam canxi cacbonat (CaCO3).
- Cho vào cốc đựng dung dịch axt sunfuric a gam nhôm.
Sau khi phản ứng kết thúc, cân vẫn ở vị trí thăng bằng.
Tính a, biết có các phản ứng xảy ra:
CaCO3 + 2HCl →CaCl2 + H2O + CO2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,m_{HCl}=\dfrac{100.7,3}{100}=7,3\left(g\right)\\ \rightarrow n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\\ m_{H_2SO_4}=\dfrac{9,8.100}{100}=9,8\left(mol\right)\\ \rightarrow n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\\ n_{CaCO_3}=\dfrac{3}{100}=0,03\left(mol\right)\\ n_{Al}=\dfrac{x}{27}\left(mol\right)\)
PTHH:
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2\uparrow+H_2O\)
ban đầu 0,03 0,2
phản ứng 0,03 0,06
sau pư 0 0,14 0,03 0,03 0,03
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) (*)
- TH1: Al hết \(\dfrac{x}{27}\)------------------------------------->\(\dfrac{x}{18}\)
- TH2: Al dư 0,1------------------------>0,1
\(b,V_{CO_2}=0,03.22,4=0,672\left(l\right)\)
\(c,m_{cốc\left(1\right)}=3+100-0,03.2=102,94\left(g\right)\)
TH1: Al tan hết
\(m_{cốc\left(2\right)}=x+100-\dfrac{x}{18}.2=\dfrac{8x}{9}+100\left(g\right)\)
Do \(m_{cốc\left(1\right)}=m_{cốc\left(2\right)}\)
\(\rightarrow102,94=\dfrac{8x}{9}+100\\ \Leftrightarrow x=3,3075\left(g\right)\)
\(V_{H_2}=\dfrac{3,3075}{18}.22,4=4,116\left(l\right)\)
- TH2: Al dư
\(m_{cốc\left(2\right)}=x+100-0,1.2=99,8+x\left(g\right)\)
\(\rightarrow102,94=99,8+x\\ \Leftrightarrow x=3,14\left(g\right)\)
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
\(d,\left\{{}\begin{matrix}C\%_{CaCl_2}=\dfrac{0,03.111}{102,94}.100\%=3,23\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,14.36,5}{102,94}.100\%=4,96\%\end{matrix}\right.\)

Giả sử ban đầu mcốc A = mcốc B = m (g)
- Xét cốc A:
\(n_{Na}=\dfrac{1,15}{23}=0,05\left(mol\right)\)
PTHH: 2Na + 2HCl --> 2NaCl + H2
0,05-------------------->0,025
=> mcốc A (sau pư) = m + 1,15 - 0,025.2 = m + 1,1 (g)
- Xét cốc B
Gọi số mol Mg thêm vào là a (mol)
PTHH: Mg + 2HCl --> MgCl2 + H2
a---------------------->a
=> mcốc B (sau pư) = m + 24a - 2a = m + 22a (g)
Do mcốc A (sau pư) = mcốc B (sau pư)
=> m + 1,1 = m + 22a
=> a = 0,05 (mol)
=> mMg = 0,05.24 = 1,2 (g)

Thí nghiệm 1 : n Na = 1,15/23 = 0,05(mol)
2Na + 2HCl → 2NaCl + H2
Theo PTHH : n H2 = 1/2 n Na = 0,025(mol)
=> m tăng = m Na - m H2 = 1,15 - 0,025.2 = 1,1(gam)
Thí nghiệm 2 :
Mg + H2SO4 → MgSO4 + H2
n H2 = n Mg = a(mol)
=> m tăng = 24a -2a = 22a
Vì hai cân ở vị trí cân bằng <=> 22a = 1,1 <=> a= 0,05
Suy ra : m Mg = 0,05.24 = 1,2(gam)

- Thí nghiệm 1 : $n_{Mg} = \dfrac{15}{24} = 0,625(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = n_{Mg} = 0,625(mol)$
$\Rightarrow m_{tăng} = m_{Mg} - m_{H_2} = 15 - 0,625.2 = 13,75(gam)$
- Thí nghiệm 2 :
$Fe + H_2SO_4 \to FeSO_4 + H_2$
Theo PTHH : $n_{H_2} = n_{Fe} = \dfrac{a}{56}(mol)$
$m_{tăng} = a - \dfrac{a}{56}.2 = \dfrac{27a}{28}(gam)$
Mà cân ở vị trí cân bằng nên $13,75 = \dfrac{27a}{28} \Rightarrow a = 14,26(gam)$

a) Fe + H2SO4 \(\rightarrow\) FeSO4+ H2
2Al + 6HCl \(\rightarrow\) AlCl3 + 3H2
a+ mH2SO4- 2a /56= b + mHCl -1,5b/27
a/b=238/243
b) CaCO3 + 2HCl \(\rightarrow\) CaCl2 + CO2 + H2O
Na2SO3 + H2SO4 \(\rightarrow\) Na2SO4 + SO2 + H2O
a+ mHCl- 44a /100= b + mH2SO4 -64b/126
a/b=775/882

Chọn B. Vì khi cho đá vôi vào dung dịch axit clohiric có phản ứng sinh ra khí cacbon dioxit thoát ra ngoài làm cho khối lượng sẽ giảm đi.
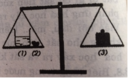
Gọi cốc chứa dung dịch HCl là A
Cốc chứa dung dịch H2SO4 là B
Theo để ta có các PTHH:
CaCO3 + 2HCl \(\xrightarrow[]{}\) CaCl2 + H2O + CO2 (1)
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 (2)
Theo đề: \(n_{CaCO_3}\)= \(\dfrac{25}{100}\)= 0,25 (mol)
Theo PTHH (1): \(n_{CO_2}\) = \(n_{CaCO_3}\) = 0,25 (mol)
=> m\(_{CO_2}\) = 0,25\(\times\)44= 11 (g)
Sau phản ứng ở phương trình (1), khí CO2 bay đi nên sau khi cho thêm 25 gam CaCO3 vào cốc A (vào dung dịch HCl) thì khối lượng cốc A tăng thêm: 25-11=14 (g)
Theo đề: nAl = \(\dfrac{a}{27}\) (mol)
Theo PTHH (2): n\(_{H_2}\)= \(\dfrac{3}{2}\)nAl = \(\dfrac{3}{2}\times\dfrac{a}{27}\)= \(\dfrac{a}{18}\) (mol)
=> m\(_{H_2}\)= \(\dfrac{a}{18}\times2\) = \(\dfrac{a}{9}\) (g)
Sau phản ứng ở phương trình (2), khí H2 bay đi nên sau khi cho thêm a gam Al vào cốc B (vào dung dịch H2SO4) thì khối lượng cốc B tăng thêm: a-\(\dfrac{a}{9}\) (g)
Theo định luật bảo toàn khối lượng thì cốc B cũng phải tăng thêm 14 g
=> a-\(\dfrac{a}{9}\) = 14 (g)
Giải ra ta được: a= 15,75 (g)
Vậy a= 15,75 g