thực hiên phản ứng nhiệt nhôm giữa bột Al với bột Fe2O3(hiệu suất=100%) được hỗn hợp X.Trộn đều hỗn hợp X thành 2 phần,phần 2 nhiều hơn phần một 134g.Cho phần 1 tác dụng với NaOH dư được 16,8(lít) H2(ở đktc).Phần 2 cho tác dụng với HCL dư được 84(lít) H2(ở đktc).Tính khối lượng các chất trong X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
![]()
· Phần 1 + NaOH → 0,75 mol H2
=> Al dư, Fe2O3 phản ứng hết.
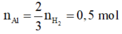
· Đặt số mol Fe, A l 2 O 3 trong phần 1 lần lượt là 2x, x.
Giả sử phần 2 có khối lượng gấp k lần phần 1.
![]() (1)
(1)
Phần 2:
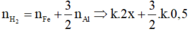
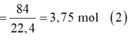
· Từ (1) và (2) suy ra:
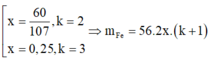
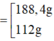
Kết hợp đáp án suy ra m F e = 112 g

Đáp án B.
2 A l + F e 2 O 3 → t o A l 2 O 3 + 2 F e
· Phần 1 + NaOH → 0,75 mol H2
=> Al dư, Fe2O3 phản ứng hết.
n A l = 2 3 n H 2 = 0 , 5 m o l
· Đặt số mol Fe, A l 2 O 3 trong phần 1 lần lượt là 2x, x.
Giả sử phần 2 có khối lượng gấp k lần phần 1.
=> (27.0,5 + 56.2x + 102x).(k – 1)=134 (1)
· Phần 2:
n H 2 = n F e + 3 2 n A l ⇒ k . 2 x + 3 2 k . 0 , 5 = 84 22 , 4 = 3 , 75 m o l ( 2 )
· Từ (1) và (2) suy ra:
x = 60 107 ; k = 2 x = 0 , 25 ; k = 3 ⇒ m F e = 56 . 2 x . ( k + 1 ) = 188 , 4 g 112 g
Kết hợp đáp án suy ra
m
F
e
=
112
g
.

Đáp án A
Ta có sơ đồ phản ứng:
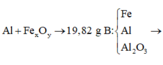
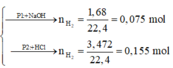
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
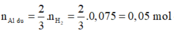
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
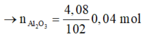
Ta có:
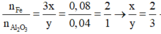
=> Oxit sắt cần tìm là Fe2O3

Chọn A
Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl=nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư: nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy:
m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 0,12 mol
=> m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam

Chọn A
Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl=nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư: nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy:
m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 0,12 mol
=> m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam

Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl=nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư: nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy:
m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 0,12 mol
=> m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam
Đáp án A

Đáp án A
Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl = nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư:
nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy: m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 = 0,12 mol => m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam

Giải thích:
Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl=nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư: nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy:
m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 0,12 mol
=> m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam
Đáp án A


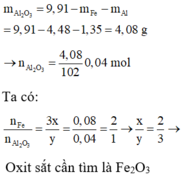
cho anh hỏi nha: khi phản ứng nhiệt nhôm:
Fe2O3 + 2 Al → 2 Fe + Al2O3
cho hỗn hợp pư với NaOH:
Al2O3 + 2NaOH = H2O + 2NaAlO2
nên không có H2 đâu em!!!