Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol của Al và Fe lần lượt là a và b
Ta có 1,5a + b = 0,25
1,5a = 0,15
=> a = 0,1 và b = 0,1
=> %Al = 32,53%
%Fe= 67,47%

\(n_{Cu} = a ; n_{Al} = b ; n_{Fe} = c(mol)\\ \Rightarrow 64a + 27b + 56c = 28,6(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5b + c = \dfrac{13,44}{22,4} = 0,6(2)\\ \text{Mặt khác} : n_{O_2} = \dfrac{8,96}{22,4} = 0,4(mol)\\ 2Cu + O_2 \xrightarrow{t^o} 2CuO\\ 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ 4Fe + 3O_2 \xrightarrow{t^o} 2Fe_2O_3\\ \)
Ta có :
\(\dfrac{n_X}{n_{O_2}}=\dfrac{a+b+c}{0,5a +0,75b + 0,75c} = \dfrac{0,6}{0,4}(3)\\ (1)(2)(3)\Rightarrow a = \dfrac{317}{1460} ; b = \dfrac{121}{365}; c = \dfrac{15}{146}\\ \%m_{Cu} = \dfrac{\dfrac{317}{1460}.64}{28,6}.100\% = 48,59\%\\ \%m_{Al} = \dfrac{\dfrac{121}{365}.27}{28,6}.100\% = 31,3\%\\ \%m_{Fe} = 100\% - 41,59\% - 31,3\% = 27,11\%\)

Phần 1
2Al +6 HCl ----> 2AlCl3 + 3H2 (1)
Fe + 2HCl ----> FeCl2 + H2 (2)
Cu ko pư với dd HCl
Phần 2
2Al + 2NaOH + 2H20 ---> 2NaAlO2 + 3H2 (3)
Fe và Cu ko pư với dd NaOH
Theo pt(3) n Al = \(\frac{2}{3}\).n H2=\(\frac{2}{3}\). \(\frac{3,36}{22,4}\)=0,1 (mol)
%m Al= \(\frac{0,1.27}{20}\).100%= 13,5%
Theo pt(1)(2) tổng n H2=\(\frac{3}{2}\). nAl + n Fe=\(\frac{5,6}{22,4}\)
==> 0,15 + n Fe = 0,25 ==> n Fe = 0,1 (mol)
%m Fe= \(\frac{0,1.56}{20}\).100%= 28%
%m Cu=100% - 13,5% - 28% =58,5%
tại sao % Al lại đem chia 20 vậy 0,1 mol là ở 1 phần thôi là chia 10 chứ .% Fe cũng thế vậy
==> tổng mAl + mFe trong 1 phần = 0,1.27 + 0,1.56=8,3
%Cu =100% - \(\dfrac{8,3}{10}\).100=17%

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
n H 2 (p1) = 3,08/22,4 = 0,1375 mol
n H 2 (p2) = 0,84/22,4 = 0,0375 mol
Thấy phần 2 tác dụng với NaOH sinh ra khí, suy ra sản phẩm có Al dư.
Vậy rắn Y gồm A l 2 O 3 , Fe và Al dư.
Phần 2:
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2
Theo PTPU ta có:
n A l (p2) = 2/3 n H 2 (p2)
= 2/3 . 0,0375 = 0,025 mol
⇒ n A l (p1) = n A l (p2) = 0,025 mol
Phần 1:
Fe + H 2 S O 4 → F e S O 4 + H 2 (*)
2Al + 3 H 2 S O 4
→ A l 2 S O 4 3 + 3 H 2 (**)
Theo (**) ta có:
n H 2 (**) = 3/2 n A l (p1)
= 3/2 . 0,025 = 0,0375 mol
⇒ n H 2 (*) = n H 2 (p1) - n H 2 (**)
= 0,1375 - 0,0375 = 0,1 mol
⇒ n F e (p1) = n H 2 (*)=0,1 mol
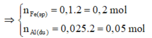
⇒ n A l pư = n F e sp = 0,2 mol
⇒ n F e 2 O 3 = 1/2 . n F e sp
= 1/2 . 0,2 = 0,1 mol
m h h = m F e 2 O 3 + m A l p u + m A l d u
= 0,1.160+0,05.27+0,2.27=22,75g
⇒ Chọn D.

\(m_{Mg}=1,2\left(g\right)\)
=> \(n_{Mg}=\dfrac{1,2}{24}=0,05\left(mol\right)\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
____0,05--------------------->0,05
2Al + 6HCl --> 2AlCl3 + 3H2
\(\dfrac{1}{30}\)<--------------------0,05
=> \(m_{Al}=\dfrac{1}{30}.27=0,9\left(g\right)\)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,9}{0,9+1,2}.100\%=42,857\%\\\%Mg=\dfrac{1,2}{0,9+1,2}.100\%=57,143\%\end{matrix}\right.\)

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

Chất rắn ko tan là Cu
Đặt \(n_{Mg}=x(mol);n_{Al}=y(mol)\Rightarrow 24x+27y=13-4=9(1)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow x+1,5y=0,45(2)\\ (1)(2)\Rightarrow x=0,15(mol);y=0,2(mol)\\ a,\%_{Cu}=\dfrac{4}{13}.100\%=30,77\%\\ \%_{Mg}=\dfrac{0,15.24}{13}.100\%=27,69\%\\ \%_{Al}=100\%-30,77\%-27,69\%=41,54\%\\ b,\Sigma n_{HCl}=2x+3y=0,9(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,9}{2}=0,45(l)\)



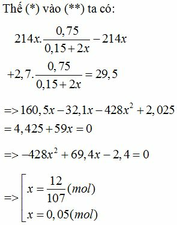
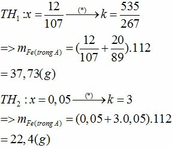

cho anh hỏi nha: khi phản ứng nhiệt nhôm:
Fe2O3 + 2 Al → 2 Fe + Al2O3
cho hỗn hợp pư với NaOH:
Al2O3 + 2NaOH = H2O + 2NaAlO2
nên không có H2 đâu em!!!