Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TL:
Glyxin: H2N-CH2-COOH (75 g/mol), axit cacboxylic: R(COOH)n.
Phần 1: Khi cho hh X phản ứng với NaOH thì muối thu được gồm: H2N-CH2-COONa và R(COONa)n.
Khí Y khi cho đi qua Ca(OH)2 dư thì CO2 và H2O bị hấp thụ còn N2 thoát ra ngoài. Do đó khối lượng tăng lên 20,54 g chính là khối lượng của hh CO2 và H2O.
Mặt khác: CO2 + Ca(OH)2 \(\rightarrow\) CaCO3 + H2O, số mol của CaCO3 là 0,34 mol = số mol của CO2.
Suy ra, khối lượng của H2O = 20,54 - 44.0,34 = 5,88 g.
Như vậy, có thể thấy trong 1/2 hh X gồm có các nguyên tố (C, H, O, và N). Theo định luật bảo toàn nguyên tố ta có:
số mol của C = n(CO2) + n(Na2CO3) = 0,34 + 0,1 = 0,44 mol.
số mol của H = 2n(H2O) + nNa = 2.5,58/18 + 2.0,1 = 0,82 mol.
số mol của O = 2nNa = 0,4 mol.
Phần 2: Khi cho phản ứng với HCl chỉ có glyxin tham gia phản ứng: H2N-CH2-COOH + HCl \(\rightarrow\) ClH3N-CH2-COOH. Số mol của glyxin = số mol của HCl = 0,04 mol.
Do đó, trong 1/2 hh X thì số mol của N = 0,04 mol.
Như vậy, khối lượng của 1/2 hh X = mC + mH + mO + mN = 12.0,44 + 0,82.1 + 16.0,4 + 0,04.14 = 13,06 gam.
Khối lượng của glyxin trong 1/2 hh X = 75.0,04 = 3 gam.
Phần trăm khối lượng của glyxin trong hh X = 3/13,06 x 100% = 22,97%. (đáp án D).

Ta có mC = 0,75m (gam) > 0,7m (gam)
\(\Rightarrow\) trong C có Fe dư
\(\Rightarrow\) HNO3 hết, trong B chỉ chứa muối Fe(NO3)2
PT:
Fe + 4HNO3 \(\rightarrow\)Fe(NO3)3 + NO + 2H2O
Fe + 6HNO3 \(\rightarrow\) Fe(NO3)3 + 3NO2 + 3H2O
Fe + 2Fe(NO3)3 \(\rightarrow\) 3Fe(NO3)2
Ta có : \(n_{hh}=\frac{2,87.1,2}{0,082.\left(273+27\right)}=0,14mol\)
\(\Rightarrow\) số mol HNO3 tạo muối = 0,44 – 0,14 = 0,3 (mol)
\(\Rightarrow\) \(n_{Fe\left(NO_3\right)_2}=0,15mol\)
\(\Rightarrow\) Khối lượng muối trong B = 0,15.180 = 27 (gam)
\(\Rightarrow\) nFe (pu) = 0,15 (mol) => mFe(pu) = 0,15.56 = 8,4 (gam)
\(m=\frac{8,4.100}{25}=33,6\left(g\right)\)

HD:
a,
2AL+3H2SO4=>AL2(SO4)3+3H2
b,
Ta có: nAL=10.8/27=0.4(mol)
theo phương trình ta có: nH2=3/2nAL=0.6(mol)
=> VCO2=0.6*22.4=13.44(lít)
c,
Ta có: nH2=11.2/22.4=0.5(mol)
theo phương trình ta có: nH2SO4=nH2=0.5(mol)
=>mH2SO4=0.5*98=49(g)

Có: nKMnO4=6,951/158= 0,044 mol
2KMnO4+ 16HCl= 2KCl+ 2MnCl2+ 5Cl2+ 8H2O (1)
nCl2= 2,5nKMno4= 2,5.0,044=0,11 mol
Gọi KL cần tìm là M có hóa trị x khi phản ứng với Cl2 và có hóa trị là y khi phản ứng với HCl
2M+ xCl2=(t0) 2MClx (2)
P1: 2M+2y HCl= 2MCly +y H2 (3)
Do phản ứng (3) có khí thoát ra nên phản ứng (2) có kim loại dư.
Ta có: nH2= 0,112/22,4= 0,005 mol
nM(3)= 0,005.2/y=0,01/y mol ---> nMdư sau pư (2)= 0,02/y mol( do chia thành chất rắn tạo thành thành 2 phần bằng nhau)
nM(2)= 0,11.2/x=0,22/x mol
=> mM= (0,02/y+0,22/x).MM=7,8 suy ra MM=7,8xy/(0,02x+0,22y)
x=y=1 ==> MM=32,5( loại)
x=3; y=2 ==> MM=93,6( loại)
x=y=3 ==> MM= 97,5( loại)
x=y=2 ==> MM=65 (Zn)
P2: Zn+ Cu(NO3)2= Zn(NO3)2+ Cu (4)
nZn(4)= nZn(3)= 0,01/y=0.01/2= 0,005 mol --> mCu= 0,005.64=0,32 g

1)2 Al +6HCl--->2AlCl3 +3H2
Fe +2 HCl --->FeCl2 +H2
2) đặt nAl=x,nFe=y =>từ phương trình ở ý 1) và theo bài ra ta có;3/2.x+y=4.48/22.4 và 27x+56y=5.5.giải hệ hai phương trình=>x=0.1 và y=0.05=>mAl=27.0.1=2.7(gam)=>% về khối lượng của Al trong hỗn hợp=(2.7/5.5).100%=49.1%=>%về khối lượng của Fe trong hỗn hợp=100%-49.1%=50.9%.
3) pt : CuO + H2----> Cu +H2O.ta có nH2=0.2(mol),nCuO=0.1(mol)=>CuO pư hết và H2 dư=> nCu=nCuO=>mCuO=0.1 nhân 64=6.4 (gam).

Chọn đáp án C
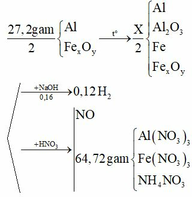
nNaOH = nNaAlO2 = nAl + 2nAl2O3 trong 0,5X = 0,16 = nAl ban đầu
nAl trong 0,5X = 0,12/1,5 = 0,08 Þ nAl2O3 = (0,16 - 0,08)/2 = 0,04
Þ nO ban đầu = 0,04x3x100/75 = 0,16
Þ mFe ban đầu = 27,2/2 - 0,16x16 - 0,16x27 = 6,72 Þ nFe ban đầu = 6,72/56 = 0,12
Þ x/y = 0,12/0,16 = 3/4 Þ Fe3O4
mMuối = 0,16x213 + 0,12x242 + 80xnNH4NO3 = 64,72 Þ nNH4NO3 = 0,02
BTE Þ 0,16x3 + 0,12 = 3nNO + 8x0,02 Þ nNO = 0,12 Þ V = 0,12x22,4 = 2,688

HD:
a) 2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
b) Số mol Al = 16,2/27 = 0,6 mol. Số mol H2 = 3/2.0,6 = 0,9 mol. Suy ra V(H2) = 0,9.22,4 = 20,16 lít.
c) Số mol H2SO4 = số mol H2 = 0,9 mol. Suy ra m(H2SO4) = 98.0,9 = 88,2 g; số mol Al2(SO4)3 = 0,3 mol. Suy ra m(Al2(SO4)3) = 0,3.342 = 102,6 g.
d) Số mol H2 = 13,44/22,4 = 0,6 mol. Số mol Al = 2/3.0,6 = 0,4 mol; số mol H2SO4 = 0,6 mol. Do đó: m(Al) = 27.0,4 = 10,8 g và m(H2SO4) = 98.0,6 = 58,8 g.
a) 2Al + 3H2SO4 -------> Al2(SO4)3 + 3H2
b) nAl = 16,2/27= 0,6 (mol)
PT: 2Al + 3H2SO4 -------> Al2(SO4)3 + 3H2
Theo PT: 2 mol 3 mol 1 mol 3 mol
Theo đề: 0,6 mol --------------------------> x mol
nH2 = x = 0,6.3/2= 0,9 (mol) => VH2 = 0,9.22,4= 20,16 (lít)
- Còn lại tự làm đê -_- lười ròi



Đáp án B.
2 A l + F e 2 O 3 → t o A l 2 O 3 + 2 F e
· Phần 1 + NaOH → 0,75 mol H2
=> Al dư, Fe2O3 phản ứng hết.
n A l = 2 3 n H 2 = 0 , 5 m o l
· Đặt số mol Fe, A l 2 O 3 trong phần 1 lần lượt là 2x, x.
Giả sử phần 2 có khối lượng gấp k lần phần 1.
=> (27.0,5 + 56.2x + 102x).(k – 1)=134 (1)
· Phần 2:
n H 2 = n F e + 3 2 n A l ⇒ k . 2 x + 3 2 k . 0 , 5 = 84 22 , 4 = 3 , 75 m o l ( 2 )
· Từ (1) và (2) suy ra:
x = 60 107 ; k = 2 x = 0 , 25 ; k = 3 ⇒ m F e = 56 . 2 x . ( k + 1 ) = 188 , 4 g 112 g
Kết hợp đáp án suy ra m F e = 112 g .