Cho 5 gam hỗn hợp bột Cu và Al vào dung dịch HCl dư thu 3,36 lít H2 ở đktc. Phần trăm Al theo khối lượng ở hỗn hợp đầu là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn B
Bảo toàn ne ⇒ 3nAl = 2nH2 ⇒ nAl = 0,1 ⇒ %mAl = 0,1.27.100%/5 = 54%

Chọn đáp án B
Vì glyxin có 1 nhóm –COOH ⇒ nGlyxin = nNaOH = 0,1 mol.
⇒ VNaOH = 0,1 ÷ 1 = 0,1 lít = 100 ml ⇒ Chọn B

Chọn đáp án D
Nhận thấy chỉ có Al tác dụng được với HCl.
+ Bảo toàn e ⇒ nAl = 2 × nH2 ÷ 3 = 0,1 mol ⇒ mAl = 2,7 gam
⇒ %mAl/hỗn hợp = 2 , 7 5 × 100 = 54% ⇒ Chọn D

Chọn đáp án A.
n H 2 = 3 , 36 22 , 4 = 0 , 15 m o l
![]()
n A l = 2 3 n H 2 = 0 , 1 m o l
→ m A l = 0 , 1 . 27 = 2 , 7 g a m
% m A l = 2 , 7 5 . 100 % = 54 %

Nhận thấy chỉ có Al tác dụng được với HCl.
+ Bảo toàn e ⇒ nAl = 2 × nH2 ÷ 3 = 0,1 mol ⇒ mAl = 2,7 gam
%mAl/hỗn hợp = 2,7/5 × 100 = 54%
Đáp án D
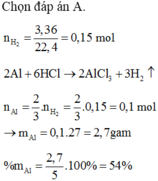
do Cu không tác dụng với HCL , AL thì tác dụng với HCL
nên ta có AL +3HCL \(\rightarrow\)ALCL3 +\(\frac{3}{2}\)H2
số mol của khí =0,15
=>số mol của AL =\(0.15\div\frac{3}{2}\)
phần trăm của AL= \(\frac{\left(0.15\div\frac{3}{2}\right)\times27}{5}\times100\)=54%
n H2 = 3,36/ 22,4 =0,15 mol
vì cho hỗn hợp vào dung dịch HCl dư thì Cu ko t/ d nên khí H2 thoát ra là của Al phản ứng :
pthh: 2Al + 6HCl ---> 2AlCl3 + 3H2
theo pthh n Al = 2/3 n H2 = 2/3. 0,15 = 0,1 mol
---> %m Al=((0,1 .27)/5) . 100 =54%