Để tác dụng hết với 35,7 gam hỗn hợp X gồm Cu, Fe, Al ở dạng bột, nung nóng cần vừa đủ 21,84 lít khí Cl2. Mặt khác, khi cho 0,25 mol hỗn hợp X tác dụng với dung dịch HCl dư thì thu được 4,48 lít khí H2. Tính % khối lượng mỗi kim loại trong hỗn hợp X. Biết thể tích các khí đó ở đktc.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
\(n_{Cl_2}\) = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
\(\%_{Cu} = \dfrac{0,2. 64}{23,8} \approx 53,78\%\)
\(\%_{Fe} = \dfrac{0,1 .56}{23,8} \approx 23,53\%\)
%Al ≈ 22,69%

Đáp án C
Đặt số mol mỗi kim loại trong 18,5 gam hỗn hợp lần lượt là a, b, c.
Ta có: mhh X =65a + 56b + 64c; n H 2 = a + b = 3 , 92 22 , 4 = 0 , 175 mol
Có số phân tử Cl2 phản ứng trung bình với hỗn hợp X:
n Cl 2 n X = 0 , 175 0 , 15 = 7 6 = ( a + 1 , 5 b + c ) ( a + b + c )
Từ đó ta có a - 2b + c = 0.
Tóm lại ta sẽ có a = b = c = 0,1 mol.
Vậy trong 18,5g hỗn họp X sẽ có 0,1 mol Fe
Chú ý:
Dung dịch axit như dung dịch HCl, HBr, HI hoặc dung dịch H2SO4 có khả năng phản ứng với các kim loại đứng trước H trong dãy điện hóa, tức là trong bài này phản ứng với Zn và Fe tạo ra ZnCl2 và FeCl2.
- Clo có khả năng phản ứng với hầu hết các kim loại (trừ Au, Pt) thậm chí còn có khả năng phản ứng với Ag ở điều kiên thích hợp và đưa kim loại lên số oxi hóa cao nhất vì vậy sản phẩm là ZnCl2,CuCl2,FeCl3

\(n_{Cl_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(n_{H_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(n_{H_2}=a+1.5b=0.5\left(mol\right)\)
\(n_{Cl_2}=1.5a+1.5b=0.6\left(mol\right)\)
\(\Rightarrow a=b=0.2\)
\(m_X=0.2\cdot\left(56+27\right)=16.6\left(g\right)\)

Đáp án : A
Trong 53,75g X có x mol Sn ; y mol Fe ; z mol Al
=> t(119x + 56y + 27z) = 53,75g
X + Cl2 -> SnCl4 ; FeCl3 ; AlCl3
⇒ t 4 x + 3 y + 3 z = 2 n C l 2 = 2 , 25 m o l
(Trong 0,4 mol lượng chất gấp t lần)
=> 9(119x + 56y + 27z) = 215(4x + 3y + 3z)
=> 211x – 141y – 402z = 0(1)
=> x + y + z = 0,4 mol(2)
n H 2 = x + y + 1,5z = 31/70 (mol) (3)
Từ (1,2,3) => z = 0,0857 mol
=> mAl = 2,314g

Gọi số mol Mg, Fe, Al là a, b, c
=> 24a + 56b + 27c = 23,8
PTHH: Mg + 2HCl --> MgCl2 + H2
a------------------------->a
Fe + 2HCl --> FeCl2 + H2
b------------------------->b
2Al + 6HCl --> 2AlCl3 + 3H2
c------------------------->1,5c
=> a + b + 1,5c = \(\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PTHH: Mg + Cl2 --to--> MgCl2
a-->a
2Fe + 3Cl2 --to--> 2FeCl3
b--->1,5b
2Al + 3Cl2 --to--> 2AlCl3
c--->1,5c
=> \(a+1,5b+1,5c=\dfrac{20,16}{22,4}=0,9\left(mol\right)\)
=> a = 0,3; b = 0,2; c = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)

Đáp án D
Xét trường hợp 20,4 gam A tác dụng với dung dịch HCl dư:
Gọi số mol các chất là Al: a mol; Zn: b mol; Fe: c mol
Ta có:

Các quá trình nhường, nhận electron:
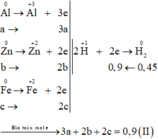
Xét trường hợp 0,2 mol A tác dụng với Cl2:
Gọi số mol các chất là Al: ka mol; Zn: kb mol; Fe: kc mol
Ta có:
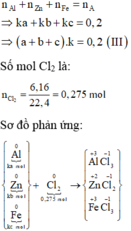
Các quá trình nhường, nhận electron:
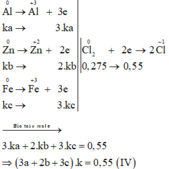
Lấy (IV) chia (III) vế với vế ta được:


Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\) => 65a + 56b + 27c = 10,65 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> \(n_{H_2}=a+b+1,5c=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) (2)
PTHH: Zn + Cl2 --to--> ZnCl2
2Fe + 3Cl2 --to--> 2FeCl3
2Al + 3Cl2 --to--> 2AlCl3
=> \(n_{Cl_2}=a+1,5b+1,5c=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\\c=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Al}=0,05.27=1,35\left(g\right)\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10,65}.100\%=61,033\%\\\%m_{Fe}=\dfrac{2,8}{10,65}.100\%=26,291\%\\\%m_{Al}=\dfrac{1,35}{10,65}.100\%=12,676\%\end{matrix}\right.\)
b) nHCl = 2a + 2b + 3c = 0,45 (mol)
=> mHCl = 0,45.36,5 = 16,425 (g)
=> \(a\%=C\%=\dfrac{16,425}{200}.100\%=8,2125\%\)
c) mdd sau pư = 10,65 + 200 - 0,225.2 = 210,2 (g)
=> \(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{210,2}.100\%=6,47\%\\C\%_{FeCl_2}=\dfrac{0,05.127}{210,2}.100\%=3,02\%\\C\%_{AlCl_3}=\dfrac{0,05.133,5}{210,2}.100\%=3,176\%\end{matrix}\right.\)
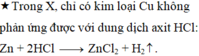



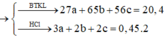
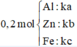
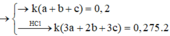
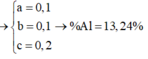
\(n_{Cu}=a\left(mol\right),n_{Fe}=b\left(mol\right),n_{Al}=c\left(mol\right)\)
\(m_X=64a+56b+27b=35.7\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{21.84}{22.4}=0.975\left(mol\right)\)
\(Cu+Cl_2\underrightarrow{^{^{t^0}}}CuCl_2\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}FeCl_3\)
\(Al+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}AlCl_3\)
\(n_{Cl_2}=a+1.5b+1.5c=0.975\left(mol\right)\left(2\right)\)
\(n_{hh}=ka+kb+kc=0.25\left(mol\right)\)
\(n_{H_2}=kb+k\cdot1.5c=0.2\left(mol\right)\)
\(\Leftrightarrow a-0.25b-0.875c=0\left(3\right)\)
\(\left(1\right),\left(2\right),\left(3\right):a=0.3,b=0.15,c=0.3\)
\(\%Cu=\dfrac{0.3\cdot64}{35.7}\cdot100\%=53.78\%\)
\(\%Fe=\dfrac{0.15\cdot56}{35.7}\cdot100\%=23.52\%\)
\(\text{%Al=22.7%}\)