Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Chọn số mol mỗi chất là 1 mol
A. Loại vì m 1 < m 2 < m 3
m 1 = + = 1.100 + 1.90 = 190 (g)
m 2 = + = 1.100 + 1.116 = 216 (g)
m 3 = mAgCl + mAg = 2.143,5 + 1.108 = 395 (g)
B. Chọn vì m 1 < m 3 < m 2
m 1 = = 90 (g) ; m 2 = = 116 (g) ; m 3 = mAg = 108 (g)
C. Loại vì m 3 > m 2 > m 1
m 1 = = 90 (g); m 2 = = 116 (g) ; m 3 = mAgCl + mAg = 3.143,5 + 1.108 = 538,5 (g)
D. Loại vì m 1 = m 2 > m 3
m 1 = = 197 (g); m 2 = = 197 (g); m 3 = mAgCl = 143,5 (g)

Chọn D.
Loại A vì dung dịch Z tác dụng với H+ không sinh ra kết tủa.
+ Nếu X là Ba, Y là Zn Þ Z chứa Ba2+: a mol và ZnO22-: a mol Þ n2 > n1 (Loại)
+ Nếu X là Ba, Y là Al Þ Z chứa Ba2+: a mol ; AlO2-: a mol ; OH- dư: a mol Þ n2 > n1 (Loại)
+ Nếu X là Na, Y là Al Þ Z chứa Na+: a mol ; AlO2-: a mol Þ n2 < n3 < n1 (Thoả)

Đáp án D
Ta có: x = 0,35 – 0,05.3 = 0,2
Tại điểm kết tủa cực đại là
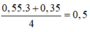
=> z = 0,2.
Khi thêm 0,27 Ba(OH)2 thì thu được kết tủa Z chứa
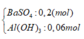
=> m = 51,28 gam

Đáp án A
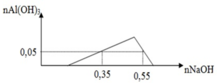
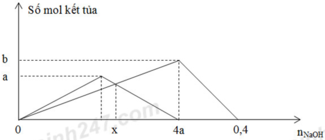
*Tại nOH- = 0,4 mol (thí nghiệm 2): Al(OH)3 vừa bị hòa tan hết
=> nOH- = 4nAl3+ => 0,4 = 4b => b = 0,1 mol
*Tại nOH- = 4a (thí nghiệm 2): Al(OH)3 đạt cực đại
=> nOH- = 3nAl(OH)3 => 4a = 3b => a = 3b/4 = 0,075 mol
*Tại nOH- = x mol: Giả sử nAl(OH)3 = nZn(OH)2 = y mol
- Thí nghiệm 2: Al(OH)3 chưa đến cực đại
nOH- = 3nAl(OH)3 => x = 3y (1)
- Thí nghiệm 1: Zn(OH)2 bị tan một phần
nOH- = 4nZn2+ - 2nZn(OH)2 => x = 4.0,075 – 2.y (2)
Giải (1) và (2) => x = 0,18; y = 0,06
=> m = mZn(OH)2 + mAl(OH)3 = 0,06.99 + 0,06.78 = 10,62 gam ≈ 10,6 gam

Đáp án A
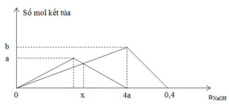
*Tại nOH- = 0,4 mol (thí nghiệm 2): Al(OH)3 vừa bị hòa tan hết
=> nOH- = 4nAl3+ => 0,4 = 4b
=> b = 0,1 mol
*Tại nOH- = 4a (thí nghiệm 2): Al(OH)3 đạt cực đại
=> nOH- = 3nAl(OH)3 => 4a = 3b
=> a = 3b/4 = 0,075 mol
*Tại nOH- = x mol: Giả sử nAl(OH)3 = nZn(OH)2 = y mol
- Thí nghiệm 2: Al(OH)3 chưa đến cực đại
nOH- = 3nAl(OH)3 => x = 3y (1)
- Thí nghiệm 1: Zn(OH)2 bị tan một phần
nOH- = 4nZn2+ - 2nZn(OH)2
=> x = 4.0,075 – 2.y (2)
Giải (1) và (2) => x = 0,18; y = 0,06
=> m = mZn(OH)2 + mAl(OH)3 = 0,06.99 + 0,06.78 = 10,62 gam ≈ 10,6 gam
Áp dụng CT nhanh: nHNO3 = 12nN2 + 10nNH4+ = 12.0,03+ 10.0,09 = 1,26 (mol)
=> VHNO3 = 1,26.22,4 = 5,04 (lít)

Đáp án B
(a) C a ( O H ) 2 + M g H C O 3 2 → M g C O 3 ↓ + C a C O 3 ↓ + 2 H 2 O → tạo 2 kết tủa
(b) F e C l 2 + 3 A g N O 3 (dư) → F e N O 3 3 + 2 A g C l ↓ + A g ↓ → tạo 2 kết tủa
(c) B a + 2 H 2 O → B a ( O H ) 2 + H 2 ↑
3 B a ( O H ) 2 + A l 2 S O 4 3 → 3 B a S O 4 ↓ + 2 A l ( O H ) 3 ↓ ( phản ứng dư A l 2 S O 4 3 )
→ tạo 2 kết tủa
(d) 4 N a O H + A l C l 3 → N a A l O 2 + 3 N a C l + 2 H 2 O
2 N a O H + C u C l 2 → C u ( O H ) 2 ↓ + 2 N a C l → tạo một kết tủa
(e) 3 B a ( O H ) 2 + 2 H 3 P O 4 → B a 3 P O 4 2 ↓ + 6 H 2 O → H 3 P O 4 dư nên
B a 3 P O 4 2 ↓ + H 3 P O 4 → 3 B a H P O 4 ↓ + H 2 O → chỉ có 1 kết tủa
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa gồm hai chất là 3

Đáp án B
Xét thí nghiệm 1 và 2 có tạo số mol kết tủa bằng nhau
=> 2 chất X và Y không thể là A l 3 + v à F e 2 + vì A l ( O H ) 3 tan trong NaOH và không tan trong N H 3
Do đó số kết tủa ở thí nghiệm 1 sẽ phải nhỏ hơn thí nghiệm 2 => không thỏa mãn đề bài

Chọn D.
(a) Ca(OH)2 dư + Mg(HCO3)2 ® CaCO3¯ + MgCO3¯ + 2H2O
(b) FeCl2 + 3AgNO3 (dư) ® Fe(NO3)3 + 2AgCl¯ + Ag¯
(c) 3Ba + Al2(SO4)3 (dư) + 6H2O ® 3BaSO4¯ + 2Al(OH)3¯ + 3H2
(d) Cho từ từ đến dư dung dịch NaOH vào dung dịch AlCl3 và CuCl2 thu được một kết tủa Cu(OH)2.
(e) Ta thấy tỉ lệ mol giữa OH- và H3PO4 là 2,67 Þ 2 muối kết tủa là Ba3PO4 và BaHPO4.


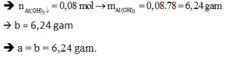
- Các hiện tượng:
TN1: xuất hiện kết tủa trắng keo.
TN2: xuất hiện kết tủa trắng, rồi kết tủa tan ngay sau mỗi lần nhỏ từng giọt dd Y vào dd X. Đến một lúc nào đó kết tủa không tan, lượng không tan là m2 .
- Các pthh:
TN1.
3NaOH + AlCl3 → Al(OH)3 + 3NaCl (1)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
TN2.
AlCl3 + 4NaOH → NaAlO2 + 3NaCl + 2H2O (3)
AlCl3 + 3NaAlO2 + 6H2O → 4Al(OH)3 + 3NaCl (4)
Sau (1): nAl(OH)3 = 0,1mol,
nNaOH dư = 0,06mol
Sau (2): nAl(OH)3 bị tan = nNaOH dư = 0,06mol;
nAl(OH)3 còn = 0,04mol
→ m1 = 0,04.78 = 3,12 gam.
Sau (3):
nNaAlO2 = 1/4.nNaOH = 0,09mol
nAlCl3 dư = 0,01mol
Sau (4):
nAl(OH)3 = 4.nAlCl3 dư = 0,04mol
→ m2 = 0,04.78 = 3,12 gam