
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 5 :
n Cu = a(mol) ; n Al = b(mol) ; n Mg = c(mol)
=> 64a + 27b + 24c = 11,5(1)
2Al + 6HCl $\to$ 2AlCl3 + 3H2
Mg + 2HCl $\to$ MgCl2 + H2
Theo PTHH :
n H2 = 1,5b + c = 5,6/22,4 = 0,25(2)
Bảo toàn electron :
2n SO2 = 2n Cu
2.0,1 = 2a (3)
Từ (1)(2)(3) suy ra a = 0,1 ; b = 0,1 ; c = 0,1
Vậy :
m Cu = 0,1.64 = 6,4 gam
m Al = 0,1.27 = 2,7 gam
m Mg = 0,1.24 = 2,4 gam

Bài 1 :
\(n_{Mg}=a\left(mol\right),n_{Zn}=b\left(mol\right)\)
\(m_{hh}=24a+65b=31.5\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{17.92}{22.4}=0.8\left(mol\right)\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{H_2}=a+b=0.8\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.5,b=0.3\)
\(m_{Mg}=0.5\cdot24=12\left(g\right)\)
\(m_{Zn}=0.3\cdot19.5\left(g\right)\)
\(n_{H_2SO_4}=n_{H_2}=0.8\left(mol\right)\)
\(C\%H_2SO_4=\dfrac{0.8\cdot98}{300}\cdot100\%=26.13\%\)

\(1)Mg + Cl_2 \xrightarrow{t^o} MgCl_2\\ 2)Cl_2 + 2NaOH \to NaCl + NaClO + H_2O\\ 3)Cl_2 + 2NaBr \to 2NaCl + Br_2\\ 4)Cl_2 + 2NaI \to 2NaCl + I_2\\ 5)Br_2 + 2NaI \to 2NaBr + I_2\\ 6)Fe + 2HCl \to FeCl_2 + H_2\\ 7)MnO_2 + 4HCl \to MnCl_2 + Cl_2 + 2H_2O\\ 8)Mg + 2HCl \to MgCl_2 + H_2\\ 9)4HF + SiO_2 \to SiF_4 + 2H_2O\)

- Hóa học có ứng dụng trong những lĩnh vực:
+ Công nghiệp năng lượng: Nhiên liệu cho động cơ đốt trong
+ Xây dựng: Cung cấp vật liệu xây dựng
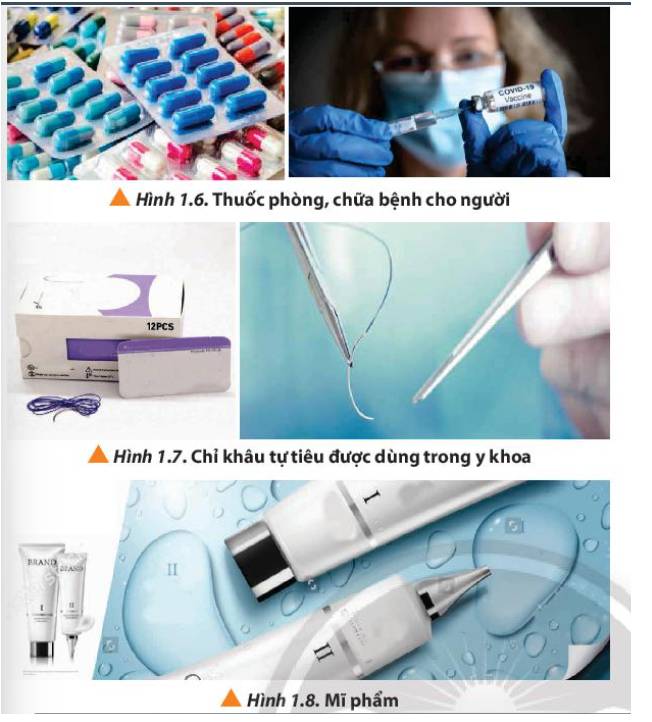
+ Y khoa: Dược phẩm, mĩ phẩm, chỉ khâu tự tiêu
+ Nông nghiệp: Phân bón cho cây trồng
+ Nghiên cứu khoa học: nghiên cứu trong phòng thí nghiệm

Có 3 yếu tố làm ảnh hưởng đến cân bằng hóa học
- Ảnh hưởng của nhiệt độ đến cân bằng hóa học
VD: N2(k) + 3H2(k) ⇔ 2NH3(k) ∆Ho = -92,6kJ.
Vì ∆H0 < 0, khi nhiệt độ tăng, cân bằng chuyển dịch theo chiều nghịch (chiều thu nhiệt), nếu nhiệt độ của hệ giảm xuống thì cân bằng chuyển dịch theo chiều thuận (chiều tỏa nhiệt).
- Ảnh hưởng của áp suất đến cân bằng hóa học
VD : N2(k) + 3H2(k) ⇔ 2NH3(k)
Có ∆n = 2 – (3 + 1) = -2
+ Nếu P tăng ⇒ cân bằng dịch chuyển theo chiều P giảm (giảm số mol khí ∆n < 0). => Cân bằng chuyển theo chiều thuận
+ Nếu P giảm ⇒cân bằng dịch chuyển theo chiều P tăng (tăng số mol khí ∆n > 0). => Cân bằng chuyển theo chiều nghịch
-Ảnh hưởng của nồng độ đến cân bằng hóa học
C(r)+CO2(k)⇌2CO(k)
- Khi tăng CO2 thì cân bằng chuyển dịch theo chiều thuận (chiều làm giảm CO2).
- Khi giảm CO2 thì cân bằng chuyển dịch theo chiều nghịch (chiều làm tăng CO2).
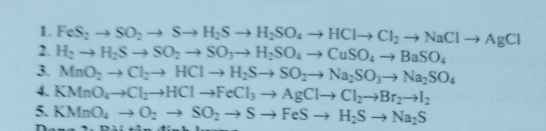










1/
\(4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2\\ SO_2 + 2H_2S \to 3S + 2H_2O\\ S + H_2 \xrightarrow{t^o,xt} H_2S\\ H_2S + 4Br_2 + 4H_2O \to 8HBr + H_2SO_4\\ H_2SO_4 + NaCl \xrightarrow{t^o} NaHSO_4 + HCl\\ MnO_2 + 4HCl \to MnCl_2 + Cl_2 + 2H_2O\\ 2Na +C l_2 \xrightarrow{t^o} 2NaCl\\ NaCl + AgNO_3 \to AgCl + NaNO_3\)
2/
\(S + H_2 \xrightarrow{t^o} H_2S\\ H_2S + \dfrac{3}{2}O_2 \xrightarrow{t^o} SO_2 + H_2O\\ 2SO_2 +O_2 \xrightarrow{t^o,xt} 2SO_3\\ SO_3 + H_2O \to H_2SO_4\\ CuO + H_2SO_4 \to CuSO_4 + H_2O\\ CuSO_4 + BaCl_2 \to BaSO_4 + CuCl)2\)
1)
4FeS2 + 11O2 -to-> 2Fe2O3 + 8SO2
SO2 + 2H2S -to-> 3S + 2H2O
S + H2 -to-> H2S
H2S + 4Br2 + 4H2O => H2SO4 + 8HBr
BaCl2 + H2SO4 => BaSO4 + 2HCl
2HCl-dp-> H2 + Cl2
Na + 1/2Cl2 -to-> NaCl
NaCl + AgNO3 => AgCl + NaNO3
2)
H2 + S -to-> H2S
2H2S + 3O2 -to-> 2SO2 + 2H2O
SO2 + 1/2O2 -to,V2O5-> SO3
SO3 + H2O => H2SO4
H2SO4 + CuO => CuSO4 + H2O
CuSO4 + BaCl2 => BaSO4 + CuCl2