Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
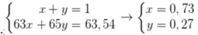
Phần trăm khối lượng của 63Cu trong Cu2O là
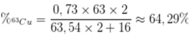

Đáp án D
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt
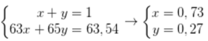
Phần trăm khối lượng của 63Cu trong CuCl2 là
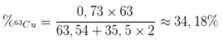

\(\overline{NTK}_{Cu}=63,54\\ \Leftrightarrow\dfrac{63.x+65.\left(100\%-x\right)}{100\%}=63,54\\ \Leftrightarrow x=73\%\\ \Rightarrow\%m_{\dfrac{^{63}Cu}{CuCl_2}}=73\%.\dfrac{63,54}{63,54+35,5.2}.100\approx34,476\%\)

Ta có: nCu = 6,354 : 63,54 = 0,1 (mol)
Gọi tỉ lệ phần trăm của đồng vị 63Cu trong tự nhiên là x
=> Tỉ lệ phần trăm của đồng vị 65Cu trong tự nhiên là 100 – x
- Nguyên tử khối trung bình của Cu là 63,54
=> \(63,54 = \frac{{63.x + 65.(100 - x)}}{{100}}\)
=> x = 73
=> Tỉ lệ phần trăm của đồng vị 63Cu trong tự nhiên là 73%
=> Trong 0,1 mol Cu sẽ có 0,1.73% = 0,073 mol 63Cu
=> Trong 0,1 mol Cu sẽ có 0,1 - 0,073 = 0,027 mol 65Cu
Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
Phần trăm khối lượng của 63Cu trong CuSO4 là