Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sau phản ứng, \(V_{dd}= V_1 + V_2(lít)\)
Ta có : [H+] = 10-3 ⇒ \(n_{H_2SO_4} = 5.10^{-4}V_1(mol)\)
Lại có: \(n_{NaOH} = V_2.\dfrac{10^{-14}}{10^{-12}} = 0,01V_2(mol)\)
pH = 4 < 7 Chứng tỏ axit dư
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,01V2.......5.10-3V2..................................(mol)
Suy ra : \(\dfrac{5.10^{-4}V_1-5.10^{-3}V_2}{V_1+V_2}.2 = 10^{-4}\\ \Rightarrow \dfrac{V_1}{V_2} = \dfrac{101}{9}\)
Đáp án B

\(pH=2\Rightarrow\left[H^+_{dư}\right]=10^{-2}\Rightarrow n_{H^+}=10^{-2}\left(V+0,4\right)\)
\(n_{H^+}=2.0,0375.0,4+0,0125.0,4=0,035\left(mol\right)\)
\(n_{OH^-}=0,3V\left(mol\right)\)
\(\Rightarrow0,035+0,3V=10^{-2}\left(V+0,4\right)\)
\(\Rightarrow V=33,1\left(l\right)\)
\(\Leftrightarrow V=\)

\(n_{NaOH}=\dfrac{8}{40}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\)\(mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2 0,2
Dung dịch thu được là \(Na_2SO_4\) có môi trường trung hòa.

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam

a, \(\left[H^+\right]=10^{-5}\Rightarrow n_{H^+}=0,22.10^{-5}\left(mol\right)\)
\(\left[OH^-\right]=10^{-5}\Rightarrow n_{OH^-}=0,18.10^{-5}\left(mol\right)\)
\(\Rightarrow n_{H^+dư}=0,04.10^{-5}=4.10^{-7}\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{4.10^{-7}}{0,22+0,18}=10^{-8}\)
\(\Rightarrow pH=8\)
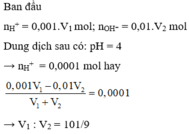
Chọn đáp án D
Chú ý : PH=2 suy ra nồng độ H+ là 0,01.Nhiều bạn sẽ cho môi trường là trung tính ngay.Nhưng các bạn chú ý nhé .HCOOH không điện ly hoàn toàn sau khi H+ đã điện ly phản ứng hết với NaOH nó lại tiếp tục điện ly ra H+ do đó môi trường sẽ là axit