Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sau phản ứng, \(V_{dd}= V_1 + V_2(lít)\)
Ta có : [H+] = 10-3 ⇒ \(n_{H_2SO_4} = 5.10^{-4}V_1(mol)\)
Lại có: \(n_{NaOH} = V_2.\dfrac{10^{-14}}{10^{-12}} = 0,01V_2(mol)\)
pH = 4 < 7 Chứng tỏ axit dư
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,01V2.......5.10-3V2..................................(mol)
Suy ra : \(\dfrac{5.10^{-4}V_1-5.10^{-3}V_2}{V_1+V_2}.2 = 10^{-4}\\ \Rightarrow \dfrac{V_1}{V_2} = \dfrac{101}{9}\)
Đáp án B

Câu 1: nOH-=0,01V(mol) nH+ =0,03V(mol)
nOH-<nH+ nên axit dư -->nH+dư =0,02V(mol)--->CM H+=0,01(M)=10-2->pH=2
Chú thích do thể tích như nhau nên ko cần đổi
Câu 2:nOH-=0,03a(mol) nH+=0,01a(mol)-->OH-dư
noh-dư=0,02a(mol) mà v=2a-->Cm oh-=0,01=10-2(M)->pH=12
Câu 3:nOH-=0,03 nH+=0,035->H+dư nH+dư=0,005 mol
V=0,5(l) CmH+=10^-2 pH=2

Đáp án D
nOH- = 0,01.2 = 0,02
nH+ = 0,2 . 0,04 = 0,008
⇒ Trong dung dịch B có nOH- = 0,02 – 0,008 = 0,012
VB = 1,2 . 10 = 12l ⇒ [OH-] = 0,001
⇒ pH = 11

\(n_{OH^-}=0.01\cdot10^{-3}\cdot V\left(mol\right)\)
\(n_{H^+}=0.03\cdot10^{-3}\cdot V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(n_{H^+\left(dư\right)}=0.03\cdot10^{-3}V-0.01\cdot10^{-3}V=0.02\cdot10^{-3}V\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.02\cdot10^{-3}}{2}=0.01\cdot10^{-3}=10^{-5}\)
\(pH=-log\left(10^{-5}\right)=5\)

Chọn đáp án D
Chú ý : PH=2 suy ra nồng độ H+ là 0,01.Nhiều bạn sẽ cho môi trường là trung tính ngay.Nhưng các bạn chú ý nhé .HCOOH không điện ly hoàn toàn sau khi H+ đã điện ly phản ứng hết với NaOH nó lại tiếp tục điện ly ra H+ do đó môi trường sẽ là axit
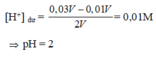
Chọn A