K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

5 tháng 1 2017
Đáp án A
Ta có nH+=0.02, nOH-=0.04 nên sau phản ứng nOH- = 0,02 và V = 0,2
→ Cm OH- = 0,1 => pH = 1

30 tháng 1 2018
Chọn A
Ta có nH2SO4 = 0,05.0,1 = 0,005 mol; nHCl = 0,1.0,1 = 0,01 mol
⇒ ∑nH+ = 2nH2SO4 + nHCl = 2.0,005 + 0,01 = 0,02 mol
nNaOH = 0,2.0,1 = 0,02 mol; nBa(OH)2 = 0,1.0,1 = 0,01 mol
⇒ ∑nOH- = nNaOH + 2nBa(OH)2 = 0,02 + 2.0,01 = 0,04 mol
Khi trộn axit với kiềm thì bản chất của phản ứng là:
H+ + OH- → H2O
(0,02) (0,04)
⇒ nOH-còn dư = 0,04 – 0,02 = 0,02 mol ⇒ [OH-] còn dư = 0,02/0,2 = 0,1M
⇒ Dung dịch X có pOH = - lg[OH-]còn dư = 1 ⇒ pH = 14 – 1 = 13

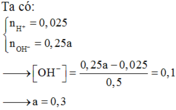
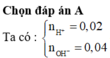
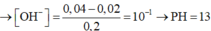

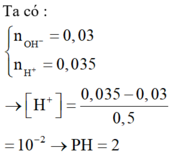
Đáp án là B
nHCl=0,006 mol
nNaOH=0,005 mol
thực hiện phản ứng trung hòa HCl dư 0,001 mol
Vdd=0,1(l)
→CM=0.01 →pH=-log(0,01)=2