Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

[K+]=[Cl-]=0,25M
[KOH dư]=0,25M
b) 2KCl + H2SO4 ----------->K2SO4 + 2HCl
0,05(mol)---->0,025(mol)
=>vH2SO4=\(\frac{0,025}{1}\)=0,025(lít)
c)pH=-log(0,25)=0,602
(câu c mình không chắc chắn lắm nha bạn!!!)
Cho mình hỏi s [K+]=[Cl-]=0,25M đc z. Mình chưa hiểu lắm

Đáp án B
Vì CH3COONa là chất điện li mạnh nên được viết trước để tạo môi trường cho cân bằng của chất điện li yếu phân li và cân bằng:
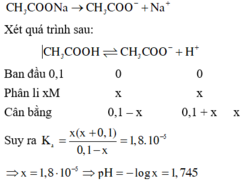

2ch3cooh + na2co3 --> 2ch3coona + co2 + h2o
0,2 (mol) <-- 0,1 (mol)
co2 + ca(oh)2 --> caco3 + h2o
0,1 (mol) <-- 0,1 (mol)
n caco3= 10/100=0,1 (mol)
v = 0,1 * 22,4 = 2,24 (l)

1. Số mol OH- = 10-4.0,1 + 10-2.0,1 = 0,00101 mol.
=> nồng độ OH- = 0,00101: 0,2 = 0,00505M
=> pOH = - lg(0,00505) = 2,3 => pH = 11,7.
2. Sai đề: pH của NaOH = 1??????

a. nHCl = 10-2. 0,01 = 10-4 mol
=> Nồng độ H+ sau pha = 10-4: (0,09 + 0,01) = 10-3 => pH dd sau pha = 3
b. nồng độ H+ sau pha = [(10-2. 0,1) + (10-3. 0,1)] : 0,2 = 0,0055M
=> pH dd sau pha = -lg(0,0055) = 2,26
c. nOH- = 0,3. 0,01 = 0,003. nH+ = 0,2. 0,01 = 0,002
=> OH- dư = 0,003 - 0,002 = 0,001 => nồng độ OH- = 0,001: (0,3+0,2) = 0,002M => pOH = -lg0,002 = 2,7 => pH = 14 - 2,7 = 11,3

a) \(n_{NaOH}=0,2.1=0,2\left(mol\right)\); \(n_{HNO_3}=0,2.0,5=0,1\left(mol\right)\)
\(NaOH+HNO_3\rightarrow NaNO_3+H_2O\)
0,2.............0,1
Lập tỉ lệ : \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\) => Sau phản ứng NaOH dư
Dung dịch D gồm NaNO3 và NaOH dư
\(n_{NaNO_3}=n_{HNO_3}=0,1\left(mol\right)\)
\(n_{NaOH\left(pứ\right)}=n_{HNO_3}=0,1\left(mol\right)\)
\(n_{NaOH\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
Ion trong dung dịch D : Na+ , NO3-, OH-
\(\left[Na^+\right]=\dfrac{0,1+0,1}{0,2}=1M\)
\(\left[NO_3^-\right]=\dfrac{0,1}{0,2}=0,5M\)
\(\left[OH^-\right]=\dfrac{0,1}{0,2}=0,5M\)
b)Trong dung dịch D chỉ có NaOH dư phản ứng
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
0,1................0,05
=> \(V_{H_2SO_4}=\dfrac{0,05}{1}=0,05\left(l\right)\)

\(n_{KOH}=0.1\cdot1=0.1\left(mol\right)\)
\(n_{H_2SO_4}=0.3\cdot0.5=0.15\left(mol\right)\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+H_2O\)
\(0.1..........0.05...............0.05\)
Dung dịch D : 0.05 (mol) K2SO4 , 0.1 (mol) H2SO4
\(\left[K^+\right]=\dfrac{0.05\cdot2}{0.1+0.3}=0.25\left(M\right)\)
\(\left[H^+\right]=\dfrac{0.1\cdot2}{0.1+0.3}=0.5\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0.05+0.1}{0.1+0.3}=0.375\left(M\right)\)
\(2NaOH+H_2SO_4\rightarrow K_2SO_4+H_2O\)
\(0.2..................0.1\)
\(V_{dd_{NaOH}}=\dfrac{0.2}{1}=0.2\left(l\right)\)

Đáp án D