Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

đâu phải bài nào đưa lên cx xong luôn đc. Với lại bài bn ms đưa lên đc có 2 phút thì bn lại lm xong rồi còn gì

\(n_{KOH}=0.3\cdot1=0.3\left(mol\right)\)
Giả sử phản ứng CO2 với KOH vừa đủ để tạo thành K2CO3 :
\(2KOH+CO_2\rightarrow K_2CO_3+H_2O\left(1\right)\)
\(n_{K_2CO_3}=\dfrac{0.3}{2}=0.15\left(mol\right)\)
\(m_{K_2CO_3}=0.15\cdot138=20.7\left(g\right)< 26.9\left(g\right)\)
=> Tạo sản phẩm có 2 muối
\(n_{CO_2\left(1\right)}=x\left(mol\right)\)
\(n_{CO_2\left(2\right)}=y\left(mol\right)\)
\(KOH+CO_2\rightarrow KHCO_3\left(2\right)\)
\(\left\{{}\begin{matrix}2x+y=0.3\\138x+100y=26.9\end{matrix}\right.\)
\(\left\{{}\begin{matrix}x=0.05\\y=0.2\end{matrix}\right.\)
\(V=0.25\cdot22.4=5.6\left(l\right)\)
\(n_{KOH}\)\(=0,3mol\)
Giả sử phản ứng tạo ra K2CO3 và KHCO3
Đặt \(n_{K_2CO_3}=a\) mol ,\(n_{KHCO_3}=b\) mol
PTHH 2KOH+CO2→K2CO3+H2O (1)
KOH+CO2→KHCO3 (2)
Theo pt (1)(2): \(n_{KOH}=2n_{K_2CO_3}+n_{KHCO_3}=2a+b=0,3\)(*)
\(m^{ }_{Muối}\) = \(m_{K_2CO_3}+m_{KHCO_3}=26,9\left(g\right)\)
=> 138a+100b=26,9(**)
Từ (*)(**) giải hệ phương tình ta có\(\left\{{}\begin{matrix}a=0,05\\b=0,2\end{matrix}\right.\)
Theo pt (1)(2):\(\Sigma_{n_{CO_2}}=a+b=0,05+0,2=0,25\) mol
=>\(V_{CO_2}=5,6\left(l\right)\)
Nếu bài cho dd chứa muối thì bạn làm kiểu này không cần xác định ra muối nào nha,nếu nó ra 1 muối thì sẽ có 1 ẩn bằng 0

n C O 2 = 11 , 2 22 , 4 = 0 , 5 m o l
Na2O + H2O → 2NaOH (1)
BaO + H2O → Ba(OH)2 (2)
Dd X thu được chứa: Ba(OH)2 và NaOH
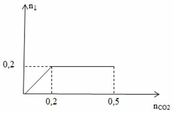
Khi sục từ từ CO2 vào dd Y ta thu được kết tủa như đồ thị hình vẽ.
Từ đồ thị ta thấy có 2 giai đoạn:
+ giai đoạn 1: đồ thị đi lên do xảy ra phản ứng:
CO2 + Ba(OH)2 → BaCO3 ↓+ H2O (3)
0,2 ← 0,2 ← 0,2 (mol)
nBaCO3 max = 0,2 (mol) => nBa(OH)2 = nBaCO3 max = 0,2 (mol)
+ giai đoạn 2: đồ thị nằm ngang, lượng kết tủa không thay đổi do xảy ra 2 phản ứng
CO2 + 2NaOH → Na2CO3 + H2O (4)
x → 2x → x (mol)
CO2 + Na2CO3 + H2O → 2NaHCO3 (5)
y → y → 2y (mol)
BTNT C: ∑ nCO2 (1,2,3) = 0,2 + x + y = 0,5
=> x + y = 0,3 (mol) (**)
Dd Y chỉ chứa 2 muối gồm: và Na2CO3 : (x-y) (mol); NaHCO3 : 2y (mol) ( do đồ thị vẫn đi ngang)
Cho từ từ dd Y + 0,3 mol HCl → 0,225 mol CO2 xảy ra phương trình sau:
Na2CO3 + HCl → NaHCO3 + NaCl (6)
(x-y) → (x – y) (mol)
NaHCO3 +HCl → NaCl + CO2↑ + H2O (7)
0,225 ← 0,225 ← 0,225 (mol)
∑ nHCl (6,7) = x – y + 0,0225 = 0,3
=> x – y = 0,075 (**)
Từ (*) và (**) => x = 0,1875 và y = 0,1125 (mol)
BTNT Na: nNa2O = nNa2CO3 + ½ nNaHCO3 = 0,075 + 0,1125 = 0,1875 (mol)
m = mBaO + mNa2O = 0,2. 153 + 0,1875.62 = 42,225 (g)

nCO2=0,075 mol
CO2 + 2KOH => K2CO3 + H2O
0,075 mol =>0,075 mol
CM dd K2CO3=0,075/0,25=0,3M

a, Ta có : \(\left\{{}\begin{matrix}n_{CaCO3}=\dfrac{m}{M}=0,2\left(mol\right)\\n_{Ca\left(OH\right)2}=C_M.V=0,4\left(mol\right)\end{matrix}\right.\)
\(BTNT\left(Ca\right):n_{Ca\left(HCO_3\right)_2}=n_{Ca\left(OH\right)2}-n_{CaCO3}=0,2\left(mol\right)\)
\(BTNT\left(C\right):n_{CO2}=n_{CaCO3}+2n_{Ca\left(HCO3\right)2}=0,6\left(mol\right)\)
\(\Rightarrow V_{CO2}=13,44l\)
b, Ta có : \(\left\{{}\begin{matrix}n_{BaCO3}=\dfrac{m}{M}=0,025\left(mol\right)\\n_{Ba\left(OH\right)2}=C_M.V=0,2\left(mol\right)\end{matrix}\right.\)
\(BTNT\left(Ba\right):n_{Ba\left(HCO_3\right)_2}=n_{Ba\left(OH\right)2}-n_{BaCO3}=0,175\left(mol\right)\)
\(BTNT\left(C\right):n_{CO2}=n_{BaCO3}+2n_{Ba\left(HCO3\right)2}=0,375\left(mol\right)\)
\(\Rightarrow V_{CO2}=8,4l\)
c, Ta có : \(1< T=\dfrac{n_{NaOH}}{n_{SO2}}=1,875< 2\)
- Áp dụng phương pháp đường chéo :
Ta được : \(\dfrac{n_{NaHSO3}}{n_{Na2SO3}}=\dfrac{1}{7}\)
\(\Leftrightarrow7n_{NaHSO3}-n_{Na2SO3}=0\)
\(BTNT\left(Na\right):n_{NaHSO3}+2n_{Na2SO3}=0,375\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaHSO3}=0,025\\n_{Na2SO3}=0,175\end{matrix}\right.\)
\(\Rightarrow m_M=24,65g\)

n SO2 = 4,48/ 22,4 = 0,2 mol
n KOH = 0,3*1 = 0,3 mol
n SO2 < n KOH --> n KOH dư
SO2 + 2KOH --- K2SO3 + H2O
0,2 < 0,3 0,2
CM K2SO4 = 0,2/0,3 = 0,666 M
\(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{KOH}=0,3.1=0,3\left(mol\right)\)
Ta có: \(T=\dfrac{n_{KOH}}{n_{SO_2}}=\dfrac{0,3}{0,2}=1,5\) ⇒ tạo ra muối K2SO3 và KHSO3
PTHH: SO2 + 2KOH → K2SO3 + H2O
Mol: x 2x x
PTHH: SO2 + KOH → KHSO3
Mol: y 2y y
Ta có: \(\left\{{}\begin{matrix}x+y=0,2\\2x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(C_{M_{ddK_2SO_3}}=\dfrac{0,1}{0,3}=0,333M\)
\(C_{M_{ddKHSO_3}}=\dfrac{0,1}{0,3}=0,333M\)

9
nSO2 = 4,48 : 22,4 = 0,2 (mol) ; nNaOH = 16: 40 = 0,4 (mol)
Ta thấy nNaOH/ nSO2 = 2 => chỉ tạo muối Na2SO3
=> mNa2SO3 = 0,2. 126 = 25, 2(g) =>D
10
nBa(OH) = 0,15.1 = 0,15mol; nBaCO3 = 19,7 : 197 = 0,1mol
Vì nBaCO3 < nBa(OH)2 → xét 2 trường hợp
Trường hợp 1: Ba(OH)2 dư, CO2 hết, phản ứng chỉ tạo muối cacbonat
CO2 + Ba(OH)2 → BaCO3 + H2O
0,1 0,1
Vậy V = VCO2 = 0,1.22,4 =2,24
Trường hợp 2: Phản ứng sinh ra 2 muối cacbonat và hiđrocacbonat
CO2 + Ba(OH)2→ BaCO3 + H2O (1)
0,1 0,1 0,1
2CO2+Ba(OH)2→Ba(HCO3)2
0,1 0,05
Theo phương trình (1): nBa(OH)2(1) = nBaCO3=0,1mol
Mà nBa(OH)2= 0,15mol →nBa(OH)2 (2) = 0,15−0,1 = 0,05mol
Theo (1) và (2): nCO2 = nBaCO3 + 2nBa(OH)2 (2) = 0,1 + 2.0,05 = 0,2 mol
Vậy V = VCO2 = 0,2.22,4 = 4,48 lít
=>A

\(\left\{{}\begin{matrix}n_{Ba\left(OH\right)_2}=0,1.0,3=0,03\left(mol\right)\\n_{KOH}=0,2.0,3=0,06\left(mol\right)\end{matrix}\right.\)
\(n_{BaCO_3}=\dfrac{5,91}{197}=0,03\left(mol\right)\)
Do nBaCO3 = nBa(OH)2 => Ba2+ bị kết tủa hết
PTHH:
(1) Ba(OH)2 + CO2 --> BaCO3 + H2O
(2) 2NaOH + CO2 --> Na2CO3 + H2O
(3) Na2CO3 + CO2 + H2O --> 2NaHCO3
- Nếu CO2 chỉ tham gia vào pư (1)
PTHH: Ba(OH)2 + CO2 --> BaCO3 + H2O
0,03<---0,03
=> nCO2(min) = 0,03 (mol) (*)
- Nếu CO2 tham gia vào pư (1), (2), (3)
PTHH: Ba(OH)2 + CO2 --> BaCO3 + H2O
0,03----->0,03----->0,03
2NaOH + CO2 --> Na2CO3 + H2O
0,06--->0,03------>0,03
Na2CO3 + CO2 + H2O --> 2NaHCO3
0,03---->0,03
=> nCO2(max) = 0,09 (mol) (**)
(*)(**) => \(0,03\le n_{CO_2}\le0,09\)
=> \(0,672\le V\le2,016\)

$n_{Ca(OH)_2} = \dfrac{185.20\%}{74} = 0,5(mol)$
$n_{CaCO_3} = 0,3(mol)$
TH1 : Ca(OH)2 dư
Ca(OH)2 + CO2 → CaCO3 + H2O
0,3..............0,3.........0,3........................(mol)
V = 0,3.22,4 = 6,72 lít
$m_{dd} = 0,3.44 + 185 - 30 = 168,2(gam)$
$C\%_{Ca(OH)_2\ dư} = \dfrac{(0,5 - 0,3).74}{168,2}.100\% = 8,8\%$
TH2 : Có tạo muối axit
Ca(OH)2 + CO2 → CaCO3 + H2O
0,3..............0,3.........0,3........................(mol)
Ca(OH)2 + 2CO2 → Ca(HCO3)2
0,2.............0,4...............0,2.........................(mol)
V = (0,3 + 0,4).22,4 = 15,68 lít
$m_{dd} = 0,7.44 + 185 - 30 = 185,8(gam)$
$C\%_{Ca(HCO_3)_2} = \dfrac{0,2.162}{185,8}.100\% = 17,4\%$
Theo gt ta có: $n_{Ca(OH)_2}=\frac{92}{185}(mol)$
+, Xét trường hợp 1: Chỉ tạo muối $CaCO_3$
$\Rightarrow n_{CO_2}=n_{CaCO_3}=0,3(mol)\Rightarrow V=6,72(l)$
Bảo toàn khối lượng ta có: $m_{dd}=167,2(g)$
$\Rightarrow \%C_{Ca(OH)_2}=8,73\%$
+, Xét trường hợp 2: Tạo 2 muối
Bảo toàn Ca ta có: $n_{Ca(HCO_3)_2}=\frac{73}{370}(mol)$
Bảo toàn C ta có: $n_{CO_2}=\frac{257}{370}(mol)\Rightarrow V_{CO_2}=15,56(l)$
$\Rightarrow \%m_{Ca(HCO_3)_2}=17,3\%$
nKOH=0.3⋅1=0.3(mol)
Giả sử phản ứng CO2 với KOH vừa đủ để tạo thành K2CO3 :
2KOH+CO2→K2CO3+H2O(1)
nK2CO3=\(\dfrac{0.3}{2}\)=0.15(mol)
mK2CO3=0.15⋅138=20.7(g)<26.9(g)
⇒ Tạo sản phẩm có 2 muối
nCO2(1)=x(mol)
nCO2(2)=y(mol)
KOH+CO2→KHCO3(2)
\(\left\{{}\begin{matrix}\text{2 x + y = 0.3 }\\\text{138 x + 100 y = 26.9}\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\text{x = 0.05}\\\text{y = 0.2}\end{matrix}\right.\)
V=0.25⋅22.4=5.6(l)