Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Pư xong, trong 2 cốc chỉ thu được dd trong suốt
→ CaCO3 và 2 kim loại A, B tan hết.
Ta có: nCaCO3 = 0,1 (mol) = nCO2
⇒ m cốc 1 tăng = mCaCO3 - mCO2 = 10 - 0,1.44 = 5,6 (g)
Mà: Sau pư khối lượng 2 cốc bằng nhau.
⇒ m cốc 2 tăng = 5,6 (g) = 5,8 - mH2
⇒ mH2 = 0,2 (g) ⇒ nH2 = 0,1 (mol)
Vì: A và B đều thuộc nhóm IA → gọi chung là X.
PT: \(2\overline{X}+2H_2O\rightarrow2\overline{X}OH+H_2\)
Theo PT: \(n_{\overline{X}}=2n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow M_{\overline{X}}=\dfrac{5,8}{0,2}=29\left(g/mol\right)\)
Mà: A và B nằm ở 2 chu kỳ liên tiếp.
⇒ A và B là: Na và K.

1:
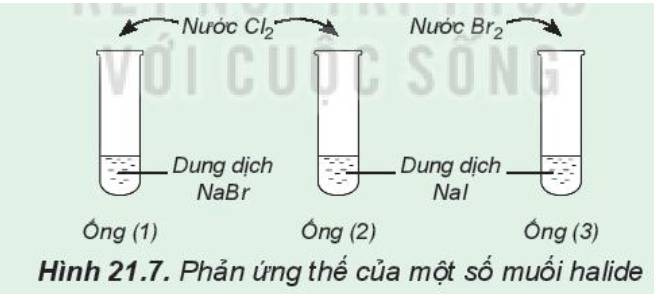
Ống nghiệm (1); dung dịch chuyển sang màu vàng
ống nghiệm (2): dung dịch có màu vàng và có chất rắn màu đen tím
ống nghiệm (3): dung dịch màu vàng nhạt dần và có chất rắn màu đen tím
2: Tính oxi hóa: Cl>Br
=>Cl đẩy Br- ra khỏi dung dịch muối
Tính oxi hóa; Br>I2
=>Br đẩy I- ra khỏi dung dịch muối
=>Tính oxi hóa; Cl2>Br2>I2
3: Để chứng tỏ có sự tạo thành I2 khi cho nước clo (hoặc nước brom) tác dụng với dung dịch sodium iốt ta có thể dùng thuốc thử là hồ tinh bột vì I2 tạo màu xanh đặc trưng với hồ tinh bột.

- Thí nghiệm 1:
+ Khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu thì tạo ra dung dịch màu vàng nâu của bromine:
Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
+ Khi nhỏ 2 mL cyclohexane vào ống nghiệm, quan sát thấy màu vàng nâu của bromine nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
- Thí nghiệm 2:
+ Khi cho nước bromine màu vàng vào dung dịch sodium iodine không màu thì tạo ra dung dịch màu vàng:
Br2(aq) + 2NaI(aq) → 2NaBr(aq) + I2(aq)
+ Khi cho thêm 2 mL cyclohexane thấy màu dung dịch nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
+ Khi thêm tiếp vài giọt hồ tinh bột thì thấy dung dịch từ màu vàng chuyển sang màu xanh tím do iodine tác dụng với hồ tinh bột

1: Sau khi cho mẩu giấy màu ẩm vào bình tam giác thì mẩu giấy sẽ mất màu.
Lý do là vì một phần khí Cl2 tác dụng với nước sinh ra HClO có tính oxi hóa mạnh, có khả năng diệt khuẩn và tẩy màu.
\(Cl_2+H_2O^{\rightarrow}_{\leftarrow}HCl+HClO\)
2: Trong phản ứng của clo với nước thì clo vừa chât oxi hóa vừa là chất khử
Nói clo tự oxi hóa-tự khử là bởi vì trong 2 phân tử Cl2 thì có 1 phân tử làm nhiệm vụ oxy hóa, còn 1 phân tử làm nhiệm vụ khử

a) Phương trình hóa học của phản ứng
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O
b) Thí nghiệm có thể xảy ra nên điều kiện phản ứng được thỏa mãn
=> Axit mới sinh ra H2CO3 yếu hơn HNO3 nên đã phân hủy thành khí CO2 và H2O

Công thức tính mol của các chất khí không phải ở điều kiện tiêu chuẩn
\(PV=nRT\Rightarrow n=\dfrac{PV}{RT}=\dfrac{PV}{0,082\cdot\left(T_o+273\right)}\)
=> \(n=\dfrac{1\cdot6,11}{0,082\left(25+273\right)}=0,25mol\)
PTHH: M + 2H2O -> M(OH)2 + H2
Mol:...0,25...................................0,25
=> M = 10/0,25 = 40
=> M là Ca

1. Sự thay đổi màu sắc trong ống nghiệm được đung nóng nhanh hơn.
2. Khi nhiệt độ tăng, tốc độ phản ứng sẽ tăng lên
1. So sánh tính kim loại của sodium và magnesium
1. Phương trình hóa học2Na + 2H2O -> 2NaOH + H2
2. Ở điều kiện thường:
- Sodium phản ứng mãnh liệt với nước, tạo dung dịch màu hồng và tỏa nhiệt.
- Magnesium không phản ứng với nước.
2. So sánh tính phi kim của chlorine và iodine
- Hiện tượng: Dung dịch không màu chuyển thành màu nâu của Iodine
=> Cl đẩy được I ra khỏi dung dịch KI => Tính phi kim của iodine yếu hơn chlorine