Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1: \(AgNO_3+NaI\rightarrow NaNO_3+AgI\downarrow\)
\(AgNO_3+NaCl\rightarrow NaNO_3+AgCl\downarrow\)
\(AgNO_3+NaBr\rightarrow NaNO_3+AgBr\downarrow\)
2: nếu xuất hiện kết tủa trắng thì ống nghiệm đó là NaCl
nếu xuất hiện kết tủa vàng nhạt thì ống nghiệm đó là NaBr
nếu xuất hiện kết tủa vàng đậm thì ống nghiệm đó là NaI
nếu ko xuất hiện kết tủa thì ống nghiệm đó là NaF

1: đầu tiên nước dd brom mất màu sau đó xuất hiện kết tủa trắng
SO\(_2\)2 + Br2 = H2SO4 + HBr
H2SO4 + BaCl = HCl + BaSO4(kết tủa)
2: xuất hiện khí mùi khai
NaOH + NH4HCO3 = NaHCO3 + NH3(khí) + H2O
3: xuất hiện khí không màu
Cu + H2SO4 = CuSO4 + SO2 + H2O \(\rightarrow\)

a) Phương trình hóa học của phản ứng
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O
b) Thí nghiệm có thể xảy ra nên điều kiện phản ứng được thỏa mãn
=> Axit mới sinh ra H2CO3 yếu hơn HNO3 nên đã phân hủy thành khí CO2 và H2O

1. Sự thay đổi màu sắc trong ống nghiệm được đung nóng nhanh hơn.
2. Khi nhiệt độ tăng, tốc độ phản ứng sẽ tăng lên

1: \(HCl+NaHCO_3\rightarrow NaCl+CO_2\uparrow+H_2O\)
2: Tính axit của HCl mạnh hơn H2CO3 vì HCl đẩy được H2CO3 ra khỏi dung dịch muối

1.
* Thí nghiệm 1: Fe + CuSO4 → FeSO4 + Cu
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: Cu+2 + 2e → Cu0
* Thí nghiệm 2: Fe + H2SO4 → FeSO4 + H2
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: 2H+ + 2e → H20
2.
* Thí nghiệm 1:
- Chất oxi hóa CuSO4
- Chất khử Fe
* Thí nghiệm 2:
- Chất oxi hóa H2SO4
- Chất khử Fe

Khi pha loãng dung dịch H2SO4
=> Nồng độ H2SO4 giảm
=> Tốc độ phản ứng giảm

1. a. dd KI xuất hiện màu đỏ tím, sau đó dần trở lại không màu
Cl2 + 2KI \(\rightarrow\) 2KCl + I2 và 5Cl2 + I2 + 6H2O \(\rightarrow\) 2HIO3 + 10HCl
b. Quá trình chuyển X2 \(\rightarrow\) 2X- phụ thuộc vào 2 yếu tố: năng lượng phân li phân tử thành nguyên tử (tức năng lượng liên kết) và ái lực e để biến nguyên tử X thành ion X-
Mặc dù ái lực của flo bé hơn clo, nhưng năng lượng liên kết của flo lại thấp hơn của clo nên flo dễ phân li thành nguyên tử hơn, vì vậy tính oxi hóa của flo mạnh hơn clo
(Năng lượng liên kết của flo thấp hơn clo vì: Trong phân tử F chỉ có các AO p, không có AO trống \(\rightarrow\) phân tử F2 chỉ có liên kết \(\sigma\). Trong nguyên tử Cl, ngoài các AO p còn có AO d trống \(\rightarrow\) phân tử Cl2 ngoài sự xen phủ các AO p để tạo liên kết \(\sigma\), thì mây e còn đặt vào AO d trống, do đó tạo một phần liên kết pi).
2. Dựa vào thể tích và khối lượng hỗn hợp khí, lập hệ pt dễ dàng tính được số mol SO2 = 0,06 và NO2 = 0,02 \(\rightarrow\) số mol e nhận = 0,06.2 + 0,02 = 0,14
Nếu tất cả kim loại đều tan thì ne nhường = 0,03.3 + 0,02.2 + 0,02.2 = 0,17 > 0,14. Như vậy có kim loại còn dư, đó là Cu (vì Cu có tính khử yếu nhất), tính được số mol Cu dư = \(\frac{0,17-0,14}{2}\) = 0,015
Ta có : NO3- + 2H+ +1e \(\rightarrow\) NO2 + H2O
0,02 0,04
SO42- +4H+ +2e \(\rightarrow\) SO2 +2H2O
0,06 0,24
nNO3 -(muối) = nNO3- (ax) – nNO2 = nH+ - nNO2 = 0,04 – 0,02 = 0,02
Tương tự tính được nSO42- = 0,06 mol. Khối lượng muối = mkim loại + mgốc axit
\(\rightarrow\) m = 0,03.27 + 0.02.65 + 0,005.64 + 0,02.62 + 0,06.96 = 9,43 (gam)
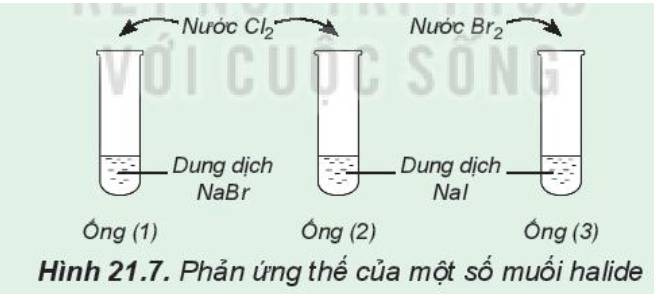
1:
Ống nghiệm (1); dung dịch chuyển sang màu vàng
ống nghiệm (2): dung dịch có màu vàng và có chất rắn màu đen tím
ống nghiệm (3): dung dịch màu vàng nhạt dần và có chất rắn màu đen tím
2: Tính oxi hóa: Cl>Br
=>Cl đẩy Br- ra khỏi dung dịch muối
Tính oxi hóa; Br>I2
=>Br đẩy I- ra khỏi dung dịch muối
=>Tính oxi hóa; Cl2>Br2>I2
3: Để chứng tỏ có sự tạo thành I2 khi cho nước clo (hoặc nước brom) tác dụng với dung dịch sodium iốt ta có thể dùng thuốc thử là hồ tinh bột vì I2 tạo màu xanh đặc trưng với hồ tinh bột.