Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nước clo dần dần bị mất màu theo thời gian, không bảo quản được lâu là do quá trình phân huỷ HClO :
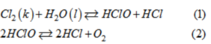
Phản ứng (2) làm cho nồng độ HClO giảm, cân bằng hoá học của phản ứng (1) chuyển dịch theo chiều thuận, clo sẽ phản ứng với nước cho đến hết, do đó nước clo không bền.

Dẫn từng khí đó đi qua nước clo có pha sẵn hồ tinh bột, chất nào tạo ra chất mới có màu xanh là HI.
Cl 2 + HI → 2HCl + I 2

Hai khí đó là HBr và HI
HBr + AgNO 3 → AgBr + H NO 3
HI + AgNO 3 → AgI + H NO 3

L tan trong H2O tác dụng với MnO2 sinh ra khí màu lục nhạt → M là Cl2.
Cl2 phản ứng với Na nóng chảy tạo ra NaCl → chất K là NaCl.
L là khí HCl.

a) Chlorine có mùi xốc, nên khi sử dụng nước sinh có chlorine, chúng ta sẽ ngửi thấy mùi của nước chlorine
b) Trong quá trình khử trùng, người ta phải cho một lượng chlorine dư vào nước sinh hoạt. Lượng chlorine dư trong nước sinh hoạt còn có tác dụng ngăn ngừa sự tái nhiễm của vi khuẩn trong quá trình phân phối trong đường ống dẫn nước và trữ nước tại nhà
c) Một số phương pháp để loại bỏ khí chlorine dư trong nước sinh hoạt:
- Sử dụng máy lọc nước than hoạt tính
- Phơi chậu nước ra ngoài ánh nắng mặt trời => Tia cực tím với cường độ cao vào nước cùng làm giảm lượng chlorine
- Sử dụng máy lọc nước RO (thẩm thấu ngược) cũng có thể giúp loại bỏ lượng chlorine trong nước

1. So sánh tính kim loại của sodium và magnesium
1. Phương trình hóa học2Na + 2H2O -> 2NaOH + H2
2. Ở điều kiện thường:
- Sodium phản ứng mãnh liệt với nước, tạo dung dịch màu hồng và tỏa nhiệt.
- Magnesium không phản ứng với nước.
2. So sánh tính phi kim của chlorine và iodine
- Hiện tượng: Dung dịch không màu chuyển thành màu nâu của Iodine
=> Cl đẩy được I ra khỏi dung dịch KI => Tính phi kim của iodine yếu hơn chlorine

Cl2+NaOH->NaCl+NaClO3+H2O
\(Cl^0\rightarrow Cl^{+5}+5e\)(x1)
\(Cl^0+1e\rightarrow Cl^{-1}\)(x5)
=>Cl vừa là chất oxi hóa, vừa là chất khử
=>PT: \(3Cl_2+6NaOH\rightarrow5NaCl+NaClO_3+3H_2O\)

Kết tủa vàng chính là S
Trong môi trường axit, Mn+7 bị khử về Mn+2