Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(CaCO_3\xrightarrow[]{t^o}CaO+CO_2\)
Một tấn đá vôi có 80% CaCO3
\(\Rightarrow m_{CaCO_3}=800\left(kg\right)\) \(\Rightarrow n_{CaCO_3}=\dfrac{800}{100}=8\left(kmol\right)=n_{CaO\left(lý.thuyết\right)}\)
\(\Rightarrow m_{CaO\left(thực\right)}=8\cdot56\cdot90\%=403,2\left(kg\right)=403200\left(g\right)\)

\(CaCO_3\underrightarrow{^{to}}CaO+CO_2\uparrow\\ n_{CaCO_3}=\dfrac{200}{100}=2\left(mol\right)\\ \Rightarrow n_{CaO}=n_{CO_2}=n_{CaCO_3}=2\left(mol\right)\\ \Rightarrow x=m_{CaO}=56.2=112\left(g\right)\\ y=m_{CO_2}=44.2=88\left(g\right)\)

\(CaCO_3-^{t^o}\rightarrow CaO+CO_2\)
\(TheoPT:n_{CaCO_3}=n_{CaO}=\dfrac{2}{56}=\dfrac{1}{28}\left(mol\right)\)
\(VìH=90\%\Rightarrow n_{CaCO_3}=\dfrac{1}{28}.\dfrac{100}{90}=\dfrac{5}{126}\left(mol\right)\\ \Rightarrow m_{CaCO_3}=\dfrac{5}{126}.100=\dfrac{250}{63}\left(tấn\right)\)
Vì CaCO3 chiếm 80% đá vôi => \(m_{đávôi}=\dfrac{250}{63}.\dfrac{100}{80}=4.96\left(tấn\right)\)

Đáp số : 381 kg CaO
Hướng dẫn:
m CaCO 3 = 80/100 x 1000 = 800(kg)
CaCO 3 → t ° CaO + CO 2
Cứ 100kg CaCO 3 thì tạo ra 56g CaO
⇒ Với 800kg CaCO 3 tạo ra:
m CaO = 800 x 56/100 = 448(kg)
Khối lượng CaO thực tế: m CaO = 448x85/100 = 380,8 (kg)

1 tấn = 1000kg
CaCO3 ---t*--> CaO + CO2
6,8mol.............6,8mol
mCaCO3 có trong 1000 kg đá vôi = 80/100 . 1000 = 800(kg)
=> m CaCO3 theo pt = (800.85)/100 = 680(kg)
=> nCaCO3 = 680/100 = 6,8(mol)
=> mCaO = 6,8 . 56 = 380,8(kg)
Chúc em học tốt!!!
trong 1 tấn có 80% CaCO3 => khối lượng của CaCO3 = 0,8 tấn => số mol CaCO3= 0,8/100=0,008
CaCO3 = CaO + CO2
theo pt ; số mol CaO = số mol CaCO3 => khối lượng CaO theo lý thuyết = 0,008.56=0,448 tấn
vì hiệu suất = 85 => khối lượng CaO thực tế thy được là : (85.0,448)/ 100 tấn

\(n_{CaO} = \dfrac{11,2.1000}{56} = 200(kmol)\\ CaCO_3 \xrightarrow{t^o} CaO + CO_2\\ n_{CaCO_3\ pư} = n_{CaO} = 200(kmol)\\ n_{CaCO_3\ đã\ dùng} = \dfrac{200}{80\%} = 250(kmol)\\ m_{CaCO_3} = 250.100 = 25000(kg)\\ \Rightarrow m_{đá\ vôi} = \dfrac{25000}{90\%} = 27777,78(kg)\)

1 tấn = 1000 kg
$CaCO_3 \xrightarrow{t^o} CaO + CO_2$
$n_{CaCO_3\ pư} = n_{CaO} = \dfrac{520}{56} = \dfrac{65}{7}(kmol)$
Suy ra:
$H = \dfrac{ \dfrac{65}{7}.100}{1000}.100\% = 92,86\%$
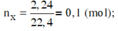
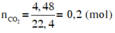
$CaCO_3 \xrightarrow{t^o} CaO +CO_2$
$n_{CaCO_3} = n_{CaO} = \dfrac{11,2}{56} = 0,2(mol)$
$m_{CaCO_3} = 0,2.100 = 20(gam)$