Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
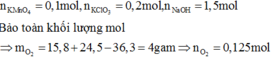
Khi cho hỗn hợp Y phản ứng với HCl đặc sẽ xảy ra phản ứng oxi hóa – khử tạo ra Cl2
![]()
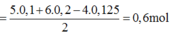


Em có thể tham khảo cách giải sau:
Ta có: mO2 = (15,8 + 24,5)-36,3 = 4 gam. => nO2 = 0,125 mol.
nKMnO4 = 0,1 mol, nKClO3 = 0,2 mol.
Mn7+ + 5e -> Mn2+
Cl5+ + 6e -> Cl-1
2O2- -> O2 + 4e
2Cl-1 -> Cl2 + 2e
Bảo toàn electron, ta có: 0,1*5 + 0,2*6 = 0,125*4 + 2*nCl2
=> nCl2 =0,6 mol.
3Cl2 + 6NaOH -> 5NaCl + NaClO3 + 3H2O (vì đun nóng).
Bđ 0,6 1,5
P/ư 0,6 1,2 1,0 0,2
Sau p/ư 0 0,3 1,0 0,2.
=> m Rắn =0,3*40 + 1,0*58,5 + 0,2*106,5 = 91,8 gam.

Đáp án A
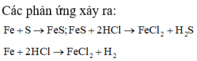
Hỗn hợp khí Z gồm H2S và H2. Đặt nFe=1mol . Dựa vào phương trình phản ứng ta thấy vì số mol khí sinh ra luôn là 1 mol với bất kì hiệu suất và tỉ lệ a:b nào nên:
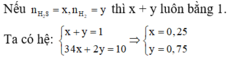
Theo đề bài hiệu suất phản ứng là 50% nhưng do chưa biết Fe hay S dư nên phải xét hai trường hợp. Tuy nhiên khi nhìn vào đáp án có thể thấy số mol sắt lớn hơn số mol lưu huỳnh nên hiệu suất được tính theo lưu huỳnh. Bảo toàn lưu huỳnh suy ra
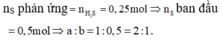

Đáp án A
Các phản ứng xảy ra:
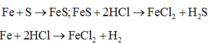
Hỗn hợp khí Z gồm H2S và H2. Đặt nFe=1mol . Dựa vào phương trình phản ứng ta thấy vì số mol khí sinh ra luôn là 1 mol với bất kì hiệu suất và tỉ lệ a:b nào nên:
Nếu ![]() thì x + y luôn bằng 1. Ta có hệ:
thì x + y luôn bằng 1. Ta có hệ:
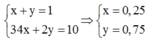
Theo đề bài hiệu suất phản ứng là 50% nhưng do chưa biết Fe hay S dư nên phải xét hai trường hợp. Tuy nhiên khi nhìn vào đáp án có thể thấy số mol sắt lớn hơn số mol lưu huỳnh nên hiệu suất được tính theo lưu huỳnh. Bảo toàn lưu huỳnh suy ra
nS phản ứng
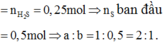

Câu 1 :\(n_{CO_2} = \dfrac{2,688}{22,4} = 0,12(mol)\)
MgCO3 + 2HCl \(\to\) MgCl2 + CO2 + H2O
..................................0,12........0,12..................(mol)
Suy ra: a = 0,12.95 = 11,4(gam)
Câu 2 :
\(Fe + 2HCl \to FeCl_2 + H_2\\ n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ \Rightarrow n_{Cu} = 2n_{Fe} = 0,15.2 = 0,3(mol)\\ 2Fe+3Cl_2\xrightarrow{t^o} 2FeCl_3\\ Cu+Cl_2 \xrightarrow{t^o} CuCl_2\\ n_{Cl_2} = \dfrac{3}{2}n_{Fe} + n_{Cu} = 0,525\\ \Rightarrow V = 0,525.22,4 =11,76(lít)\)

Chọn đáp án C
Gọi số mol của NaBr là x mol; NaI là y mol.
Cho B r 2 vào dung dịch A, chỉ NaI phản ứng.
NaI + 1 2 Br2 → NaBr + 1 2 I2
1 mol NaI → 1 mol NaBr khối lượng giảm 47g
→ n N a I = 7 , 05 47 = 0,15 mol = y
Khi sục khí Clo vào dung dịch A, cả NaBr và NaI phản ứng.
m m u ố i g i ả m = x.(80 – 35,5) + y (127-35,5) = 22,625 g
→ x = 0,2 mol
ð % m N a B r = 0 , 2 . 103 0 , 2 . 103 + 0 , 15 . 150 .100(%) = 47,80(%)
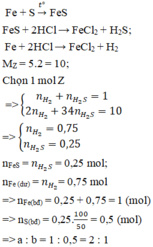

\(n_A=\dfrac{8,96}{22,4}=0,4\left(mol\right)\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,3\left(mol\right)\\n_{Cl_2}=0,1\left(mol\right)\end{matrix}\right.\)
PT: \(H_2+Cl_2\underrightarrow{^{t^o}}2HCl\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,1}{1}\), ta được H2 luôn dư nếu pư hoàn toàn.
Gọi: nCl2 (pư) = a (mol) ⇒ nCl2 (dư) = 0,1 - a (mol)
Theo PT: nHCl = 2nCl2 (pư) = 2a (mol)
PT: \(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
__0,1-a____________0,1-a_____0,1-a (mol)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
2a________________2a (mol)
⇒ 12,34 = mNaCl + mNaClO = 58,5.(0,1 - a + 2a) + 74,5.(0,1 - a)
⇒ a = 0,06 (mol)
\(\Rightarrow H\%=\dfrac{0,06}{0,1}.100\%=60\%\)