Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Ta có số mol khí ban đầu là
n = 0,5 + 1,5 = 2 (mol)
Vì có
n
H
2
3
=
n
N
2
1
nên hiệu suất phản ứng tính theo N2 hoặc H2
Gọi x là số mol N2 phản ứng. Ta có:
N2 + 3H2 ⇌ 2NH3
x 3x 2x (mol)
Số mol N2 còn lại là: (0,5 - x) (mol)
Số mol H2 còn lại là: (1,5 - 3x) (mol)
Số mol NH3 sinh ra là: 2x (mol)
=> Số mol ở áp suất P1 là
n1 = (0,5 - x) + (1,5 - 3x) + 2x = (2 - 2x) (mol)
Áp dụng công thức n = PV/RT
Do phản ứng trong bình có thể tích V không đổi , sau phản ứng đưa về nhiệt độ t°C ban đầu nên:
P2/P1 = n2/n1 = số mol sau phản ứng / số mol trước phản ứng (*)
H2SO4 hấp thụ hoàn toàn NH3 theo PT:
2NH3+ H2SO4→ (NH4)2SO4
nên khí sau phản ứng chỉ có N2 và H2 với tổng số mol là:
n2 = (0,5 - x) + (1,5 - 3x) = 2 - 4x
Thay vào (*)
P2/P1 = (2 - 2x) / (0,2 - 4x)
=> P2 .(2 - 4x) = (2 - 2x)P1
Do P1=1,75P2
=> P2.(2 - 4x) = (2 - 2x).1,75P2
=> x = 0,3 (mol)
Hiệu suất phản ứng là:
H% = (0,3/0,5).100% = 60 %

Đáp án D
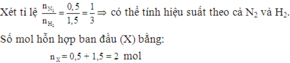
Gọi số mol N2 phản ứng là x mol ⇒ số mol NH3 là 2x mol.
Sau khi cho một lượng dư dung dịch H2SO4 đặc vào bình thì toàn bộ NH3 bị hấp thụ hoàn toàn:
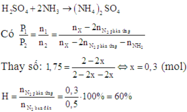

Đáp án C.
N2+ 3H2 ⇌ 2NH3
Vì có  nên hiệu suất phản ứng tính theo N2 hoặc H2
nên hiệu suất phản ứng tính theo N2 hoặc H2
Giả sử ban đầu có 1 mol N2 và 3 mol H2, nkhí ban đầu= 4 mol
→nN2 pứ= 1.20%= 0,2 mol
N2+ 3H2 ⇌ 2NH3
Ban đầu 1 3 mol
Phản ứng 0,2 0,6 0,4 mol
Sau pứ 0,8 2,4 0,4 mol
nkhí sau pứ= 0,8 + 2,4 + 0,4= 3,6 mol
Trong cùng điều kiện nhiệt độ và thể tích thì tỉ lệ về số mol chính là tỉ lệ về áp suất


Đáp án A
N2 và H2 theo tỷ lệ thể tích là 1 : 4 tính hiệu suất theo N2
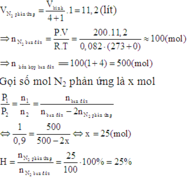

Đáp án D
Giả sử trộn 1 mol X và 15 mol Y → số mol O2 : 3 mol, số mol N2 : 12 mol
Gọi số mol của CO2 và H2O lần lượt 7x và 4x mol
Bảo toàn nguyên tố O → 7x. 2 + 4x = 3.2 → x = 1/3 mol
Vậy sau phản ứng trong bình chứa 7/3mol CO2 , 4/3 mol H2O và 12 mol N2
Có trong cùng điều kiện nhiệt độ thể tích thì


H 2 S O 4 + n H 2 O → H 2 S O 4 .n H 2 O
2NaOH + C O 2 → N a 2 C O 3 + H 2 O
Số mol
C
O
2
là: 
Khối lượng C trong hỗn hợp A là: 0,095.12 = 1,14 (g).
Khối lượng H trong hỗn hợp A là: 1,3 - 1,14 = 0,16 (g).
Số mol
H
2
O
sau phản ứng là: 
Để tạo ra 0,095 mol C O 2 cần 0,095 mol O 2 ;
Để tạo ra 0,08 mol H 2 O cần 0,04 (mol) O 2 .
Số mol O 2 đã tham gia phản ứng là: 0,095 + 0,04 = 0,135 (mol).
Số mol
O
2
ban đầu là: 
Số mol O 2 còn dư là: 0,155 - 0,135 = 0,02 (mol).
Số mol 3 chất trong bình sau phản ứng:
0,095 + 0,08 + 0,02 = 0,195 (mol).
Nếu ở đktc thì V O = 0,195.22,4 = 4,37 (lít).
Thực tế V2 = 8,4 lít
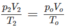
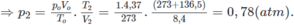
2. Đổi thể tích hỗn hợp khí trước phản ứng về đktc:
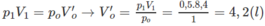
Số mol khí trước phản ứng: 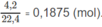
Số mol 2 hiđrocacbon: 0,1875 - 0,155 = 0,0325 (mol).
Đặt lượng C n H 2 n là a mol, lượng C m H 2 m - 2 là b mol, ta có a + b = 0,0325.
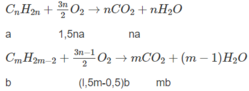
Số mol O 2 : l,5na + (l,5m - 0,5)b = 0,135 (2)
Số mol C O 2 : na + mb = 0,095 (3)
Từ (2) và (3), tìm được b = 0,015 ⇒ a = 0,0175
Thay các giá trị của a và b vào (3), ta có :
1,75. 10 - 2 n + 1,5. 10 - 2 m = 9,5. 10 - 2
7n + 6m = 38
Nếu n = 2 thì 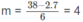
Nếu n = 3 thì 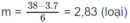
Nếu n > 3 thì m < 2 (loại).
% về thể tích của
C
2
H
4
: 
% về thể tích của C 4 H 6 là 46,2%
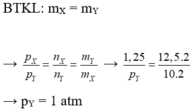
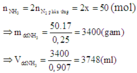
Đáp án C.
STUDY TIP: Việc đặt số mol hỗn hợp ban đầu bằng 1 mol giúp quá trình tính toán đơn giản hơn, do đó nó rất hiệu quả để giải nhanh các bài tập trắc nghiệm.