Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


b.
4P + 5O2 → 2P2O5
0,16→ 0,2
Dư: 0,025
Sau pứ m(bình 1) = mP2O5 = 11,36 (g)
O2 + 2C → 2CO
0,025→ 0,05 0,05
Dư: 0,25
Sau pứ m(bình 2) = mCdư = 3 (g)

a, \(m_{HCl}=200.14,6\%=29,2\left(g\right)\Rightarrow n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,4 0,8 0,4 0,4
\(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
b, \(m_{Zn}=0,4.65=26\left(g\right)\)
c, mdd sau pứ = 26 + 200 - 0,4.2 = 225,2 (g)
\(C_{M_{ddZnCl_2}}=\dfrac{0,4.136.100\%}{225,2}=24,16\%\)

a) $n_{CaCO_3} = 0,15(mol)$
$CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O$
$n_{HCl} = 2n_{CaCO_3} = 0,3(mol)$
$m_{dd\ HCl} = \dfrac{0,3.36,5}{7,3\%} = 150(gam)$
b)
$n_{CaCl_2} = n_{CO_2} = n_{CaCO_3} =0,15(mol)$
$V_{CO_2} = 0,15.22,4 = 3,36(lít)$
c)
$m_{dd} = 15 + 150 - 0,15.44 = 158,4(gam)$
$C\%_{CaCl_2} = \dfrac{0,15.111}{158,4}.100\% = 10,51\%$

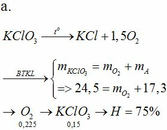
m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
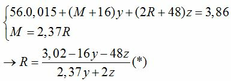
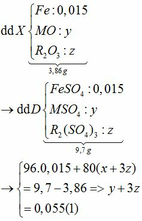
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

a)
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{11,2}{22,4} = 0,5(mol)$
$A = 0,5.56 = 28(gam)$
b) $n_{HCl} = 2n_{H_2} = 1(mol)$
$m_{HCl} = 1.36,5 = 36,5(gam)$
c) $m_{dd\ HCl} = 36,5 : 20\% = 182,5(gam)$
$m_{dd\ sau\ pư} = 28 + 182,5 - 0,5.2 = 209,5(gam)$
$C\%_{FeCl_2} = \dfrac{0,5.127}{209,5}.100\% = 30,3\%$

PTHH: \(Fe+S\xrightarrow[]{t^o}FeS\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\\n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Lưu huỳnh còn dư
\(\Rightarrow n_{FeS}=0,05\left(mol\right)=n_{S\left(dư\right)}\) \(\Rightarrow\left\{{}\begin{matrix}m_{FeS}=0,05\cdot88=4,4\left(g\right)\\m_{S\left(dư\right)}=0,05\cdot32=1,6\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeS}=\dfrac{4,4}{4,4+1,6}\cdot100\%\approx73,33\%\\\%m_{S\left(dư\right)}=26,67\%\end{matrix}\right.\)
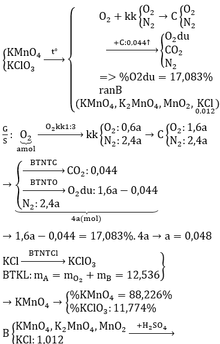
\(n_{KMnO_4}=\frac{632}{158}=4(mol)\\ a/ 2KMnO_4 \buildrel{{t^o}}\over\longrightarrow MnO_2+O_2+K_2MnO_4\\ b/\\ n_{MnO_2}=\frac{1}{2}.n_{KMnO_4}=\frac{1}{2}.4=2(mol)\\ m_{MnO_2}=87.2=174(g)\\ c// n_{O_2}=\frac{1}{2}.n_{KMnO_4}=\frac{1}{2}.4=2(mol)\\ V_{O_2}=2.22,4=44,8(l) \)
PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
Ta có: \(n_{O_2}=n_{MnO_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}\cdot\dfrac{632}{158}=2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{MnO_2}=2\cdot87=174\left(g\right)\\V_{O_2}=2\cdot22,4=44,8\left(l\right)\end{matrix}\right.\)