Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe + CuSO4 = FeSO4 + Cu
Sau phản ứng khối lượng thanh sắt tăng lên, chứng tỏ có 1 lượng Cu bám lên thanh sắt.
Khối lượng Cu phản ứng là: 16,4 - 15,6 = 0,8 (g)
Số mol Cu là: 0,8 : 64 = 0,0125 (mol)
Theo PTHH: n Fe= nCu = 0,0125 (mol)
Khối lượng sắt tham gia phản ứng là: 0,0125 x 56 = 0,7(g)

PTHH: Fe + CuSO4 --> FeSO4 + Cu
______a------------------------------>a
=> 64a - 56a = 0,2
=> 0,025 (mol)
=> mFe(pư) = 0,025.56 = 1,4 (g)
=> mCu = 0,025.64 = 1,6 (g)

Đặt nFe(pứ)=a(mol)
PTHH Fe +CuSO4------>FeSO4+Cu
Theo phương trình =>nFe=nCu=a(mol)
mđinh sắt tăng=mcu-mFe=64a-56a=0,2(g)
=>a=0,025(mol)
=>mFe(pứ)=0,025.56=1,4(g)
mCu=0,025.64=1,6(g)

n C U S O 4 = x.0,2 mol
F e + C u S O 4 → F e S O 4 + C u
x.0,2 x.0,2 x.0,2 (mol)
Khi nhúng thanh Fe vào dung dịch C u S O 4 , thanh Fe lúc sau có khối lượng tăng lên 1,6 gam là:
m C u b a m v a o - m F e tan = 1,6 g
⇔ 0,2x.64 - 0,2x.56 = 1,6
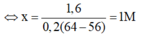
⇒ Chọn C.

\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{CuSO4}=0,2.1=0,2\left(mol\right)\)
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu\downarrow\)
a) Xét tỉ lệ : \(\dfrac{0,4}{1}>\dfrac{0,2}{1}\Rightarrow Fedư\)
Hỗn hợp rắn khan gồm : Fe dư và Cu
\(m_{Fe\left(dư\right)}=\left(0,4-0,2\right).56=11,2\left(g\right)\)
\(\%m_{Fe}=\dfrac{11,2}{31,04}.100\%=36,08\%\)
\(\%m_{Cu}=100\%-36,08\%=63,92\%\)
b) \(m_{Fe\left(dư\right)}=\left(0,4-0,2\right).56=11,2\left(g\right)\)
c) Pt : \(Fe+6HNO_3\rightarrow Fe\left(NO_3\right)_3+3NO_2+3H_2O\)
Chúc bạn học tốt
a) Để tính phần trăm về khối lượng các chất có trong 31,04g chất rắn, ta cần biết khối lượng của từng chất. Ta sẽ tính như sau:
Khối lượng CuSO4 = thể tích ddCuSO4 * nồng độ * khối lượng phân tử
= 200ml * 1M * (63.55g + 32.07g + 4 * 16g)
= 200 * 1 * 159.55g
= 31,910g
Phần trăm CuSO4 = (khối lượng CuSO4 / khối lượng chất rắn) * 100%
= (31,910g / 31,04g) * 100%
≈ 102.8%
Phần trăm Fe = (khối lượng Fe / khối lượng chất rắn) * 100%
= ((31,04g - 31,910g) / 31,04g) * 100%
≈ -2.9%
b) Vì Cu bám hoàn toàn vào thanh sắt, nên khối lượng Cu sau phản ứng sẽ bằng khối lượng chất rắn thu được. Do đó, mFe = 31,04g.
c) Phản ứng hòa tan thanh Fe bằng HNO3 đặc nóng tạo ra ddA và khí NO2 duy nhất bay ra. Phản ứng có thể được viết như sau:
3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O

Tham khảo:
PTHH: Fe + CuSo4 ---->FeSo4 + Cu
Gọi a(mol) là số mol của Fe phản ứng
mCu - mFe = 3.5 - 2.3 = 1.2(g)
<--> 64a - 56a = 1.2
<--> 8a = 1.2
<--> a = 0.15
Dựa vào PTHH: nFe = nFeSo4 = 0.15(mol)
--> mFeSo4 = 0.15×152 = 22.8(g)

Ta có PT: Fe + CuSO4 -----> FeSO4 + Cu
Gọi x là số mol Fe đã pư
=> nCu= x ( mol)
Ta có : mkim loại tăng = mCu - mFe = 64x - 56x = 4,2 - 4 = 0,2
=> x = 0,025(mol)
mFe đã phản ứng= 0,025. 56 = 1,4(g)
m\(CuSO_4\) đã phản ứng = 0,025 . 160 = 4(g)
m\(FeSO_4\) thu được = 0,025 . 152 = 3,8(g)
mCu thu được = 0,025 . 64 = 1,6(g)