Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

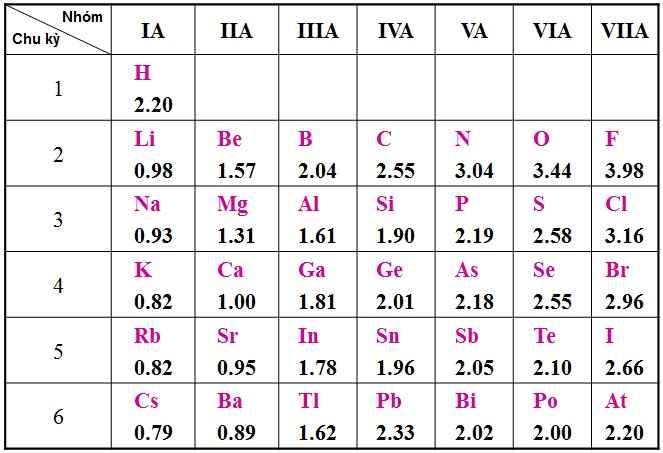
Hiệu độ âm cực càng lớn thì độ phân cực càng mạnh.
---
Áp dụng bài tập:
Hiệu độ âm điện của NH3: 3,04 - 2,2= 0,84
Hiệu độ âm điện của H2S: 2,58 - 2,2= 0,38
Hiệu độ âm điện của H2O: 3,44 - 2,2= 1,24
Hiệu độ âm điện của H2Te: 2,2 - 2,1= 0,1
Hiệu độ âm điện của CsCl: 3,16 - 0,79= 2,37
Hiệu độ âm điện của CaS: 2,58 - 1= 1,58
Hiệu độ âm điện của BaF2: 2,58 - 0,89= 1,69
Ta thấy: 2,37 > 1,69 > 1,58 > 1,24 > 0,84 > 0,38 > 0,1
=> Thứ tự độ phân cực: CsCl > BaF2 > CaS > H2O > NH3 > H2S > H2Te

- Trong phân tử NH3: độ âm điện của H và N lần lượt là 2,2 và 3,0
⟹ Nguyên tử N hút electron liên kết mạnh hơn H gấp 3,0 : 2,2 = 1,36 lần.
- Trong phân tử H2O: độ âm điện của H và O lần lượt là 2,2 và 3,4
⟹ Nguyên tử O hút electron liên kết mạnh hơn H gấp 3,4 : 2,2 = 1,54 lần.
Vậy cặp electron liên kết trong phân tử H2O bị lệch nhiều hơn trong phân tử H2O.

a)
- Phân tử H2S:
+ Năng lượng liên kết của S – H là: 368 kJ mol-1.
+ Vì có 2 liên kết S – H
⟹ Tổng năng lượng liên kết trong phân tử H2S là: 368.2 = 736 (kJ mol-1)
- Phân tử H2O:
+ Năng lượng liên kết của O – H là: 464 kJ mol-1.
+ Vì có 2 liên kết O – H
⟹ Tổng năng lượng liên kết trong phân tử H2O là: 464.2 = 928 (kJ mol-1)
b)
- Ta thấy năng lượng liên kết của H2S là 38 kJ mol-1 ; của H2O là 928 kJ mol-1.
⟹ Năng lượng liên kết của H2S < H2O.
⟹ Liên kết của H2O bền hơn H2S.
⟹ Nhiệt độ phân hủy của H2O > H2S.
Đáp án D.