Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bắt đầu xuất hiện kết tủa nghĩa là: NaOH đầu tiên sẽ trung hòa HCl dư trước
NaOH + HCldư → NaCl + H2O
0,2 ←0,2
→ 2V1 = 0,2 → V1 = 0,1
Đến khi kết tủa không thay đổi khối lượng thì khi đó kết tủa bị hòa tan hết.
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
3x ←x → x
NaOH + Al(OH)3 → NaAlO2 + 2H2O
x ←x
→ 0,2 + 4x = 0,6.2 → x = 0,25
=> y = 0,025
=> m = 17,75g

\(n_{H2SO4}=1\left(mol\right);n_{H2}=0,3\left(mol\right);n_{NaOH}=0,2\left(mol\right)\)
Tạo kết tủa ngay \(\Rightarrow\) H2SO4 hết
\(\Sigma n_{NaOH}=2,4\left(mol\right)\)
Gọi a , b , c là số mol của Al , Al2O3 , CuO
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
a____1,5a___________0,5a______1,5a
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
b______3b__________b___________
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
c_______c___________c__________
Ta có hệ phương trình :
\(\left\{{}\begin{matrix}1,5a+3b+c=1\\1,5a=0,3\end{matrix}\right.\)
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
0,5a+b_____3a+6b_______a+2b________1,5a+3b
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
c________2c_____________________c
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
a+2b_______a+2b_______a+2b________
\(\Rightarrow3a+6b+2c+a+2b=2,4\)
\(\Rightarrow4a+8b+2c=2,4\)
Giải hệ phương trình :
\(\left\{{}\begin{matrix}1,5a+3b+c=1\\1,5a=0,3\\4a+8b+2c=2,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\\c=0,4\end{matrix}\right.\)
\(\%_{Al}=\frac{0,2.27.100}{0,2.27+0,1.106+0,4.80}=11,25\%\)
\(\%_{Al2O3}=\frac{0,1.106.100}{0,2.27+0,1.106+0,4.80}=22\%\)
\(\%_{CuO}=66,75\%\)
b,
C chứa \(1,5a+3b+c=1\left(mol\right)Na_2SO_4\)
______\(a+2b=0,4\left(mol\right)NaAlO_2\)
\(n_{Al2O3}=0,1\left(mol\right)\)
\(2Al\left(OH\right)_3\underrightarrow{^{to}}Al_2O_3+H_2O\)
0,2_________0,1_________
\(NaAlO_2+HCl+H_2O\rightarrow Al\left(OH\right)_3+NaCl\)
_________0,2______________0,2___________
\(\Rightarrow V_{HCl}=0,2\left(l\right)=200\left(ml\right)\)

nHCl = 0,5.1,4 = 0,7 (mol) ; nH2SO4 = 0,5.0,5 = 0,25 (mol) => nSO42- = nH2SO4 = 0,25 (mol)
∑ nH+ = nHCl + 2nH2SO4 = 0,7 + 2.0,25 = 1,2 (mol)
nNaOH = 2V (mol) ; nBa(OH)2 = 4V (mol)
∑ nOH- = nNaOH + 2nBa(OH)2 = 2V + 2.4V = 10V (mol)
Các PTHH xảy ra:
H+ + OH- → H2O (1)
Ba2+ + SO42- → BaSO4↓ (2)
Khi cho Zn vào dd C thấy có khí H2 thoát ra => có 2 trường hợp có thể xảy ra. Zn có thể bị hòa tan bởi dung dịch axit hoặc bazo
nH2 = 3,36 : 22,4 = 0,15 (mol)
TH1: dd C có chứa H+ dư => phản ứng (1) OH- phản ứng hết
Zn + 2H+ → Zn2+ + H2↑ (3)
0,3 ← 0,15 (mol)
=> nH+ (1) = ∑ nH+ - nH+ dư = 1,2 – 0,3 = 0,9 (mol)
Theo (1): ∑nOH- = nH+ (1) = 0,9 = 10V => V = 0,09 (lít)
nBa(OH)2 = 4.0,09 = 0,36 => nBa2+ = nBa(OH)2 = 0,36 (mol) > nSO42-
Từ PTHH (2) => nBaSO4 = nSO42- = 0,25 (mol) => mBaSO4 = 0,25.233 = 58,25(g)
TH2: dd C có chứa OH- dư => phản ứng (1) H+ phản ứng hết
Zn + 2OH- → ZnO22- + H2↑ (4)
0,3 ← 0,15 (mol)
=> ∑ nOH- = nOH-(1) + nOH- (4) = 1,2 + 0,3 = 1,5 (mol)
=> 10V = 1,5
=> V = 0,15 (lít)
=> nBa(OH)2 = 0,15. 4 = 0,6 (mol)
=> nBa2+ = 0,6 (mol) > nSO42- = 0,25 (mol)
=> mBaSO4 = 0,25.233 = 58,25 (g)

1.
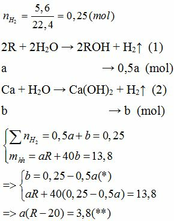
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
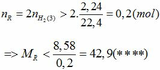
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
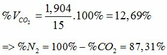
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
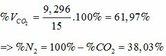

Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 2,22 (1)
\(n_{HNO_3}=0,5.0,5=0,25\left(mol\right)\)
\(n_{NO}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Có nHNO3 > 4.nNO => HNO3 dư
PTHH: \(Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
_______a------>4a------------->a----------->a____________(mol)
\(Fe+4HNO_3\rightarrow Fe\left(NO_3\right)_3+NO+H_2O\)
_b------>4b------------>b------------>b__________________(mol)
=> a + b = 0,05 (2)
(1)(2) => \(\left\{{}\begin{matrix}a=0,02\left(mol\right)\\b=0,03\left(mol\right)\end{matrix}\right.\)
=> A \(\left\{{}\begin{matrix}n_{Al\left(NO_3\right)_3}=0,02\left(mol\right)\\n_{Fe\left(NO_3\right)_3}=0,03\left(mol\right)\\n_{HNO_3\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\)
\(n_{NaOH}=1.0,21=0,21\left(mol\right)\)
PTHH: \(HNO_3+NaOH\rightarrow NaNO_3+H_2O\)
_______0,05------->0,05_______________________(mol)
\(Fe\left(NO_3\right)_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaNO_3\)
__0,03---------->0,09---------->0,03_______________(mol)
\(Al\left(NO_3\right)_3+3NaOH\rightarrow3NaNO_3+Al\left(OH\right)_3\downarrow\)
_-0,02----------->0,06------------------------->0,02_____(mol)
\(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
__0,03-------->0,015__________________(mol)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
__0,02-------->0,01___________________(mol)
=> \(m_{rắn}=0,015.160+0,01.102=3,42\left(g\right)\)

