Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, nNO=1.1222.4=0.05(mol)1.1222.4=0.05(mol)
Gọi nAl=a(mol)
.....nFe=b(mol)
Ta có 27a + 56b = 2.22(g) (*)
Quá trình cho e
AlO.................➞ Al+3 + 3e
a......................................3a(mol)
FeO.................➞ Fe+3 + 3e
b......................................3b(mol)
Quá trình nhận e
N+5 + 3e ➞..N+2
.........0.15.....0.05 (mol)
Áp dụng định luật bảo toàn electron ta có
3a + 3b = 0.15(**)
Giải (*) và (**) ta được a=0.02(mol),b=0.03(mol)
%Al=0.02∗272.22∗1000.02∗272.22∗100%=24.324%
%Fe=100%-24.324%=75.676%
b, ddA chứa: Al3+ 0.02 mol, Fe3+ 0.03 mol, HNO3 dư 0.05 mol => số mol ion dương = 0.2 mol
nNaOH = nOH- = 0.21 mol > 0.2 mol. Vậy OH- dư, nOH- dư = 0.21 - 0.2 = 0.01 mol
Fe(OH)3 kết tủa trước vì Fe(OH)3 có tích số tan lớn hơn nhiều Al(OH)3.
Fe3+ + 3OH- ---> Fe(OH)3
nFe(OH)3 = nFe3+ = 0.03 mol
Al3+ + 3OH- ---> Al(OH)3 (1)
nAl(OH)3 (1) = nAl3+ = 0.02 mol
Al(OH)3 + OH- ---> (AlO2)- + 2H2O
nOH- = 0.01 mol => nAl(OH)3 tan = 0.01 mol => nAl(OH)3 còn lại = 0.02 - 0.01 = 0.01 mol
Chất rắn còn lại: Fe(OH)3 0.03 mol, Al(OH)3 0.01 mol
2Fe(OH)3 ---> Fe2O3 + 3H2O...........2Al(OH)3 ---> Al2O3 + 3H2O
0.03.................0.015...............
m (oxit) = 0.015 x 160 + 0.005 x 102 = 2.91g

Em tham khảo nhé !
Đặt nAl = a và nFe = b
—> 27a + 56b = 3,28 (1)
nHCl = 0,5 và nNaOH = 0,65
—> nNaCl = 0,5
TH1: Nếu kết tủa vẫn còn Al(OH)3 —> nNaAlO2 = 0,65 – 0,5 = 0,15
Kết tủa gồm Fe(OH)2 (b) và Al(OH)3 (a – 0,15)
Nung ngoài không khí —> Al2O3 (a – 0,15)/2 và Fe2O3 (b/2)
m rắn = 102(a – 0,15)/2 + 160b/2 = 1,6 (2)
(1)(2) —> Vô nghiệm, loại
TH2: Kết tủa chỉ có Fe(OH)2 (b mol)
—> m rắn = 160b/2 = 1,6 (3)
(1)(3) —> a = 0,08 và b = 0,02
—> %Al = 65,85% và %Fe = 34,15%

* tac dung voi NaỌH:
Al + NaOH + 3H2O --> Na[Al(OH)4] + 3/2H2
nH2 = 0,12 mol => nAl = 0,08 mol.
* Khi cho them HCl:
FeCO3 + 2HCl ---> FeCl2 + H2O + CO2 (1)
CO2 + Ca(OH)2 --> CaCO3 + H2O
=> n(ket tua) = 0,1 => nCO2 = 0,1 mol.=> nHCl(1) = 0,2 mol
=> n(FeCO3) = nCO2 = 0,1 mol
Fe + 2HCl ---> FeCl2 + H2
*Rắn C chinh ka Cu:
Cu + 4HNO3 ---> Cu(NO3)2 + 2NO2 + 2H2O
n(NO2) = 0,05 mol => nCu = 0,025 mol.
* Cho NaOH dư vao dd D:
Cu(NO3)2 + 2NaOH ---> Cu(OH)2 + 2NaNO3
Cu(OH)2 -------------t0-----> CuO + H2O
nCuO = nCu = 0,025 mol
=> mCuO = 80*0,025 = 2gam.
* Khoi luong cac chat trong hon hop A là:
mAl = 27*0,08 = 2,16 gam.
mFeCO3 = 0,1 * 116 = 11,6 gam
mCu = 64* 0,025 = 1,6 gam.
mFe = 20 - (mFeCO3 + mAl + mCu) = 4,64 gam.

D chứa 2 oxide: \(MgO,Fe_2O_3\) (oxide 2 kim loại có tính khử cao nhất)
Vậy hỗn hợp A dư, muối đồng(II) hết.
B gồm Cu, Fe
\(Mg+CuSO_4->MgSO_4+Cu\\ Fe+CuSO_4->MgSO_4+Cu\\ MgSO_4+2NaOH->Mg\left(OH\right)_2+Na_2SO_4\\FeSO_4+2NaOH->Fe\left(OH\right)_2+Na_2SO_4 \\ Mg\left(OH\right)_2-^{^{t^{^0}}}->MgO+H_2O\\2 Fe\left(OH\right)_2+\dfrac{1}{2}O_2-^{^{ }t^{^{ }0}}->Fe_2O_3+2H_2O\\ n_{Mg}=a;n_{Fe\left(pư\right)}=b\\ \Delta m\uparrow=9,2-6,8=40a+8b=2,4\left(I\right)\\ 40a+\dfrac{160b}{2}=6\left(II\right)\\ \Rightarrow a=b=0,05mol\\ m_B=9,2=64\left(a+b\right)+56n_{Fe\left(dư\right)}\\ n_{Fe\left(dư\right)}=0,05\left(mol\right)\\ \%m_{Mg}=\dfrac{24.0,05}{6,8}.100\%=17,65\%\\ \%m_{Fe}=82,35\%\)
Bước 1: Viết các phương trình phản ứng
Phản ứng 1: Mg + CuSO4 -> MgSO4 + Cu
Phản ứng 2: Fe + CuSO4 -> FeSO4 + Cu
Phản ứng 3: Cu(OH)2 -> CuO + H2O
Bước 2: Tính toán số mol của chất rắn B
Khối lượng chất rắn B = 9,2g
Khối lượng mol CuSO4 = 63.55g/mol + 32.07g/mol + (4 * 16g/mol) = 159.62g/mol
Số mol CuSO4 = 9,2g / 159.62g/mol = 0.0577 mol
Vì phản ứng 1 và phản ứng 2 xảy ra hoàn toàn, nên số mol Mg và Fe trong hỗn hợp A cần tìm là 0.0577 mol.
Bước 3: Tính toán % số mol mỗi kim loại trong A
Khối lượng mol Mg = 24.31g/mol
Khối lượng mol Fe = 55.85g/mol
% số mol Mg trong A = (0.0577 mol * 24.31g/mol) / 6.8g * 100% = 20.34%
% số mol Fe trong A = (0.0577 mol * 55.85g/mol) / 6.8g * 100% = 47.28%
Vậy, % số mol mỗi kim loại trong hỗn hợp A là: Mg: 20.34% và Fe: 47.28%.

\(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\\n_{Fe_2O_3}=c\left(mol\right)\\n_{CuO}=d\left(mol\right)\end{matrix}\right.\)⇒ 56a + 64b + 160c + 80d = 12,4(1)
BT e : \(2n_{SO_2} = 3n_{Fe} + 2n_{Cu}\)
⇒ 3a + 2b = \(2. \dfrac{2,8}{22,4} = 0,25\) ⇔ 8(3a + 2b) = 0,25.8 ⇔ 24a + 16b = 2(2)
Lấy (1) + (2),ta có :
80a + 80b + 160c + 80d = 12,4 + 2 = 14,4
Bảo toàn nguyên tố với Fe,Cu
2Fe → Fe2O3
a..............0,5a.........(mol)
Cu → CuO
b............b...............(mol)
Fe2O3 → Fe2O3
c....................c...............(mol)
CuO → CuO
d...................d................(mol)
Vậy :
\(m_Z = m_{Fe_2O_3} + m_{CuO} = 160(0,5a + c) + 80(b+d)\\ = 80a + 80b + 160c + 80d \\= 14,4(gam)\)

có n NO = 0,04 mol và dd có axit dư => ko tạo muối amoni
Al : x mol
Fe y mol
=> 27x + 56y = 1,95
3x +3y = 0,04.3
=> x =0,01 , y = 0,03
=> m Al = 0,27g, m Fe = 1,68 g
bạn gọi số mol của Fe(OH)2 : x mol
Fe(OH)3 : y mol
vì sau khi nung chỉ có Fe2O3 và Al2O3
0,015 0,0075
x + y = n Fe = 0,03 mol
n OH- = 4n Al 3+ - n kết tủa
=> 0,165 - 2x -3y = 4.0,03 - 0,015
=> 2x + 3y = 0,06
=> x = 0,03, y = 0 => Al đẩy Fe 3+ xuống Fe 2+ hoàn toàn
=> n Al tác dụng với HNO3 còn lại = 0,01 mol
=> n NO thoát ra = 0,01 mol
=> tổng n NO thoát ra = 0,05 mol
=> n HNO3 = 0,05.4 = 0,2 mol
=> Cm = 1,25 M



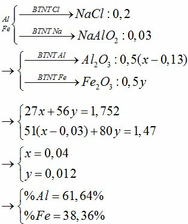
Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 2,22 (1)
\(n_{HNO_3}=0,5.0,5=0,25\left(mol\right)\)
\(n_{NO}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Có nHNO3 > 4.nNO => HNO3 dư
PTHH: \(Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
_______a------>4a------------->a----------->a____________(mol)
\(Fe+4HNO_3\rightarrow Fe\left(NO_3\right)_3+NO+H_2O\)
_b------>4b------------>b------------>b__________________(mol)
=> a + b = 0,05 (2)
(1)(2) => \(\left\{{}\begin{matrix}a=0,02\left(mol\right)\\b=0,03\left(mol\right)\end{matrix}\right.\)
=> A \(\left\{{}\begin{matrix}n_{Al\left(NO_3\right)_3}=0,02\left(mol\right)\\n_{Fe\left(NO_3\right)_3}=0,03\left(mol\right)\\n_{HNO_3\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\)
\(n_{NaOH}=1.0,21=0,21\left(mol\right)\)
PTHH: \(HNO_3+NaOH\rightarrow NaNO_3+H_2O\)
_______0,05------->0,05_______________________(mol)
\(Fe\left(NO_3\right)_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaNO_3\)
__0,03---------->0,09---------->0,03_______________(mol)
\(Al\left(NO_3\right)_3+3NaOH\rightarrow3NaNO_3+Al\left(OH\right)_3\downarrow\)
_-0,02----------->0,06------------------------->0,02_____(mol)
\(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
__0,03-------->0,015__________________(mol)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
__0,02-------->0,01___________________(mol)
=> \(m_{rắn}=0,015.160+0,01.102=3,42\left(g\right)\)