Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Đặt nMgO=a;nFe2O3=b(mol) (a,b>0)
=> 40a+160b=32 (1)
PTHH:
Fe2O3+3H2----->2Fe+3H2O (*)
b 3b 2b 3b (mol)
Từ PTHH (*) => nFe=2b (mol)
Do MgO không phản ứng với H2 nên chất rắn X gồm: MgO,Fe.
=> 40a+56.2b=24,8 (2)
Từ (1) và (2) => \(\hept{\begin{cases}a=0,2\\b=0,15\end{cases}}\)
=> \(\hept{\begin{cases}mMgO=0,2.40=8\left(g\right)\\mFe2O3=0,15.160=24\left(g\right)\end{cases}}\)
=> \(\hept{\begin{cases}\%mMgO=25\%\\\%mFe2O3=75\%\end{cases}}\)
b) Từ PTHH (*) => nFe= 2.0,2=0,4 (mol)
PTHH:
MgO+2HCl----->MgCl2+H2O
0,2 0,4 0,2 0,2 (mol)
Fe+2HCl----->FeCl2+H2
0,4 0,8 0,4 0,4 (mol)
Từ PTHH => nHCl=1,2 (mol); nH2=0,4 (mol)
=> \(V_{ddHCl}=\frac{1,2}{2}=0,6\left(l\right);V_{H2}=0,4.22,4=8,96\left(l\right)\)
CHÚC BẠN HỌC TỐT !!!

Theo bài có pthh:
Fe2O3 + 3H2 -> 2Fe + 3H2O (1)
FeO + H2 -> Fe + H2O (2)
Fe + 2HCl -> FeCl2 + H2 (3)
Theo bài ra ta có:
nFe(pt3) = \(\dfrac{1}{2}\) . nHCl = \(\dfrac{1}{2}\) . 0,4 = 0,2 mol
Gọi a, b lần lượt là số mol của Fe2O3 và FeO (a,b>0)
=> mFe2O3 = a. MFe2O3 = 160a (g)
mFeO = b. MFeO = 72b (g)
=> mhh = mFe2O3 + mFeO
⇔ 15,2 = 160a + 72b (I)
Theo pthh ta có:
nFe(pt1) = 2 . nFe2O3 = 2a (mol)
nFe(pt2) = nFeO = b (mol)
=> nFe(tgpư) = nFe(bđ) = nFe(pt1) + nFe(pt2)
⇔ 0,2 = 2a + b (II)
Từ (I)(II) ta có hệ phương trình:
+ 160a + 72b = 15,2
+ 2a + b = 0,2
=> a = 0,05(TM) ; b = 0,1 (TM)
=> nFe2O3 = a = 0,05 mol
nFeO = b = 0,1 mol
=> %mFe2O3 = \(\dfrac{mFe2O3.100\%00}{m_{hh}}\) = \(\dfrac{8.100\%}{15,2}\) ≈ 52,63 %
=> %mFeO = 100% - 52,63% = 47,37%
Ta có: nHCl = 0,4 mol ; nFe = 0,2 mol
=> nH2 = 1/2 . nHCl = nFe = 0,2 mol
=> VH2 = nH2 . 22,4 = 0,2 . 22,4 = 4,48 (l)
Vậy...

\(a,n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\\
Fe+2HCl\rightarrow FeCl_2+H_2\\
n_{Fe}=n_{H_2}=0,2mol\\
m_{Fe}=0,2.56=11,2g\\
m_{Cu}=25-11,2=13,8g\\
b,\%m_{Fe}=\dfrac{11,2}{25}\cdot100=44,8\%\\
\%m_{Cu}=100-44,8=55,2\%\)
c, Gọi CTHH của sắt là \(Fe_xO_y\)
\(Fe_xO_y+yH_2\xrightarrow[t^0]{}xFe+yH_2O\\ \Rightarrow n_{Fe_xO_y}=n_{H_2}:y\\ \Leftrightarrow\dfrac{11,6}{56x+16y}=\dfrac{0,2}{y}\\ \Leftrightarrow11,6y=11,2x+3,2y\\ \Leftrightarrow11,6y-3,2y=11,2x\\ \Leftrightarrow8,4y=11,2x\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{8,4}{11,2}=\dfrac{3}{4}\\ \Rightarrow x=3;y=4\\ \Rightarrow CTHH:Fe_3O_4\)

CuO + H2 → Cu + H2O
x x ( mol )
Fe2O3 + 3H2 → 2Fe + 3H2O
y 2y ( mol )
Fe + 2HCl → FeCl2 + H2↑
Gọi nCuO = x ( mol )
nFe2O3 = y ( mol )
mCuO = 80x ( g )
mFe2O3 = 160x ( g )
mhhbđ = 80x + 160y ( g )
mhhkl = 64x + 112y ( g )
Ta có hpt :
80x + 160y
64x + 112y
Từ đó suy ra mol x, y tính được khối lượng CuO, Fe2O3
Tính % khối lượng CuO bằng cách lấy khối lượng CuO chia khối lượng hỗn hợp ban đầu, %Fe2O3 lấy 100% trừ %CuO
Chúc bạn làm bài tốt!
Gọi số mol của CuO, Fe2O3 trong 4,8 g hh lần lượt là x, y (x,y >0)
80x+160y=4,8 (1)
CuO + H2 \(\rightarrow\)Cu+ H2O
x x (mol)
Fe2O3 + 3H2 \(\rightarrow\)2Fe + 3H2O
y y (mol)
64x+2.56y=3,52 (2)
Giải hệ pt (1) (2):
x=0,02
y=0,02
mCuO= 0,02.80=1,6 (g)
mFe2O3=0,02.160=3,2 (g)
%CuO= \(\frac{1,6}{4,8}\).100%=33,33%
%Fe2O3=\(\frac{3,2}{4,8}\).100%=66,67%

Bài 4:
a) nH2= 6,72/22,4= 0,3(mol)
Đặt:nMg= x(mol); nZn=y(mol) (x,y>0)
PTHH: Mg + 2 HCl -> MgCl2 + H2
x_______2x________x_____x(mol)
Zn + 2 HCl -> ZnCl2 + H2
y____2y____y________y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24x+65y=15,4\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
mMg=0,1.24=2,4(g)
=>%mMg = (2,4/15,4).100=15,584%
=>%mZn= 84,416%
b) nHCl(tổng)= 0,6(mol)
=> VddHCl=0,6/1=0,6(l)
Chúc em học tốt!

2Al + 3H2SO4 => Al2(SO4)3 + 3H2
x 1,5x
Zn + H2SO4 => ZnSO4 + H2
y y
27x + 65y = 9,2
1,5x + y = 5,6/22,4
=> x= 0,1 y= 0,1
%Al = 29,348%
%Zn = 70,652%

Câu 1
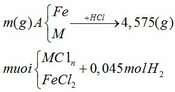
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
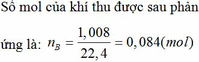
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
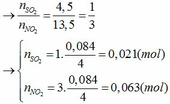
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
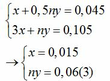
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

