Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Dùng quỳ tím:
+ Hóa xanh -> dd NaOH
+ Hóa đỏ -> dd HCl, dd H2SO4 -> Nhóm I
+ Không đổi màu -> dd BaCl2, dd Na2SO4 -> Nhóm II
- Dùng dd BaCl2 cho nhóm I:
+ Kết tủa trắng BaSO4 -> Nhận biết dd H2SO4
+ Không có kt -> dd HCl
- Dùng dd H2SO4 cho nhóm II:
+ Có kt trắng BaSO4 -> dd BaCl2
+ Không có kt -> dd Na2SO4
PTHH: H2SO4 + BaCl2 -> BaSO4 (kt trắng) + 2 HCl

- Dùng một ít các dung dịch làm mẫu thử
- Cho các dd tác dụng với nhau, ta có bảng:
| NaOH | MgCl2 | Al2(SO4)3 | H2SO4 | BaCl2 | |
| NaOH | - | kết tủa trắng, không tan
| kết tủa trắng, tan dần vào dd | - | - |
| MgCl2 | kết tủa trắng, không tan
| - | - | - | - |
| Al2(SO4)3 | kết tủa trắng, tan dần vào dd | - | - | - | kết tủa trắng, không tan |
| H2SO4 | - | - | - | - | kết tủa trắng, không tan |
| BaCl2 | - | - | kết tủa trắng, không tan | kết tủa trắng, không tan | - |
- Kết quả:
+ Chất có xuất hiện 1 kết tủa trắng không tan và 1 kết tủa trắng có tan trong dd: NaOH, Al2(SO4)3 (1)
+ Chất có xuất hiện 1 kết tủa trắng không tan: MgCl2, H2SO4 (2)
+ Chất có xuất hiện 2 kết tủa trắng không tan: BaCl2
- Cho dd BaCl2 tác dụng với 2 dd ở (1)
+ Kết tủa trắng: Al2(SO4)3
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow3BaSO_4\downarrow+2AlCl_3\)
+ Không hiện tượng: NaOH
- Cho dd BaCl2 tác dụng với 2 dd ở (2)
+ Kết tủa trắng: H2SO4
\(H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\)
+ Không hiện tượng: MgCl2
\(2NaOH+MgCl_2\rightarrow2NaCl+Mg\left(OH\right)_2\downarrow\)
\(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\downarrow\)
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow3BaSO_4\downarrow+2AlCl_3\)
\(H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\)

Chọn C
Cho quỳ tím lần lượt vào các dung dịch trên:
+ Quỳ tím chuyển sang màu xanh: NaOH
+ Quỳ tím chuyển sang màu đỏ (II): HCl, H 2 S O 4
- Cho dung dịch BaC l 2 vào 2 lọ ở dãy (II)
+ Dung dịch xuất hiện kết tủa trắng là H 2 S O 4 , còn lại không có hiện tượng là HCl
![]()

- Lấy mỗi chất một ít làm mẫu thử và đánh STT.
- Nhúng quỳ tím vao các mẫu thử.
+ Mẫu làm quỳ hóa đỏ: HCl, H2SO4
+ Mẫu làm quỳ hóa xanh: Ba(OH)2, NaOH
+ Mẫu không làm quỳ đổi màu: NaCl, BaCl2
- Lấy một trong 2 axit cho tác dụng với muối:
TH1: Trong các mẫu muối không phản ứng => Axit đã dùng là HCl => Axit còn lại là H2SO4.
Cho axit H2SO4 tác dụng với muối.
+ Mẫu không phản ứng: NaCl
+ Mẫu phản ứng, tạo kết tủa trắng: BaCl2
\(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
Cho axit H2SO4 tác dụng với các bazo.
+ Mẫu phản ứng nhưng không có hiện tượng đặc trưng: NaOH
+ Mẫu phản ứng, tạo kết tủa trắng: Ba(OH)2
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2H_2O\)
TH2: Trong các mẫu muối có một mẫu phản ứng, tạo kết tủa trắng => Mẫu muối đó là BaCl2 => Mẫu muối còn lại là NaCl, mẫu axit đã dùng là H2SO4 => Mẫu axit còn lại là HCl. (Phương trình tương tự bên trên)
Tương tự cho axit H2SO4 tác dụng với bazo như trên để nhận biết 2 bazo còn lại.

a. Trích mẫu, cho tác dụng từng đôi một
| HCl | \(H_2SO_4\) | \(Na_2SO_4\) | \(BaCl_2\) | |
| HCl | - | - | - | - |
| \(H_2SO_4\) | - | - | - | kết tủa |
| \(Na_2SO_4\) | - | - | - | kết tủa |
| \(BaCl_2\) | - | kết tủa | kết tủa | - |
Nhận thấy:
- Mẫu thử không cho hiện tượng: HCl
- Mẫu thử cho 2 kết tủa: dung dịch barium chloride
- 2 mẫu thử còn lại không thể nhận biết được do chưa đủ dữ kiện.

Xử lí bài tập nhận biết, ta chỉ cần thử 1 trong 5 hóa chất hữu dụng sau: Ba(OH)2, H2SO4, AgNO3, Quì tím, HCl. Trích mỗi ống nghiệm ra làm nhiều mẫu thử, đánh số thứ tự để thuận tiện đối chiếu kết quả thực nghiệm.
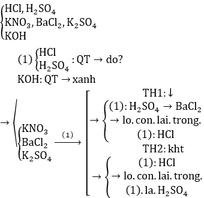
Lấy ngẫu nhiên 1 lọ thuộc nhóm (1) (nhóm axit) để nhận biết nhóm (2)
Dùng BaCl2 nhận biết KNO3 và K2SO4
Pt: BaCl2 + H2SO4 → 2HCl + BaSO4↓
BaCl2 + K2SO4 → 2KCl + BaSO4↓
* Dung dịch kiềm
( ví dụ NaOH… ) * Kết tủa xanh lơ : Cu(OH)2
Muối của Fe(II)
(dd lục nhạt ) * Kết tủa trắng xanh bị hoá nâu đỏ trong nước :
2Fe(OH)2 + H2O + ½ O2 2Fe(OH)3
( Trắng xanh) ( nâu đỏ )
Muối Fe(III) (dd vàng nâu) * Kết tủa nâu đỏ Fe(OH)3
d.dịch muối Al, Cr (III) …
( muối của Kl lưỡng tính ) * Dung dịch kiềm, dư * Kết tủa keo tan được trong kiềm dư :
Al(OH)3 ( trắng , Cr(OH)3 (xanh xám)
Al(OH)3 + NaOH NaAlO2 + 2H2O