Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Để tăng tốc độ của phản ứng oxi hoá Fe 2 + , người ta sử dụng giàn mưa. Nước ngầm sau khi hút lên bể chứa được đưa qua giàn mưa với mục đích tăng diện tích tiếp xúc của nước với oxi không khí.

Gọi p, e, n là số proton, số electron và số nơtron trong một nguyên tử M; p’, e’, n’ là số proton, số electron và số nơtron trong một nguyên tử X.
Trong nguyên tử số proton = số electron; các hạt mang điện là proton và electron, hạt không mang điện là nơtron.
+ Trong phân tử của M2X2 có tổng số hạt proton, nơtron và electron là 164 nên suy ra:
2(2p + n) + 2(2p’ + n’) = 164 (1)
+ Trong đó số hạt mang điện nhiều hơn hạt không mang điện là 52 nên suy ra:
(4p + 4p’) - 2(n + n’) = 52 (2)
+ Số khối của M lớn hơn số khối của X là 23 đơn vị nên ta có suy ra:
(p + n) - (p’ + n’) = 23 (3)
+ Tổng số hạt electron trong M+ nhiều hơn trong X22- là 7 hạt nên suy ra:
(2p + n - 1) - 2(2p’ + n’) + 2 = 7 (4)
Giải hệ (1), (2), (3), (4) ta được p = 19 ⇒ M là kali; p’ = 8 ⇒ X là oxi.
Công thức phân tử của hợp chất là K2O2.
*Tk

a) Có p+n+e = 40
=> 2p + n = 40
Mà n - p = 1
=> p=e=13; n = 14
A= 13+14 = 27
Điện tích hạt nhân là 13+
b)
Cấu hình: 1s22s22p63s23p1
=> X nhường 3e để đạt cấu hình electron bền của khí hiếm, tạo ra ion dương
X0 --> X3+ + 3e

a)
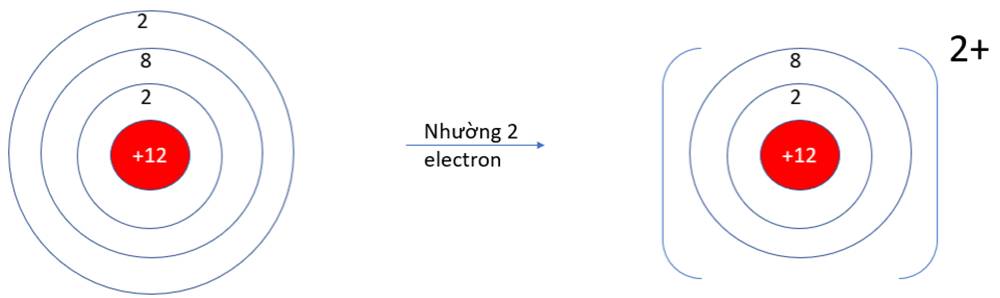
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.

Đáp án D
Trong cùng 1 nhóm năng lượng ion hoá thứ nhất giảm dần theo chiều tăng của điện tích hạt nhân do đó bán kính Si < C
Trong cùng 1 CK năng lượng ion hoá thứ nhất tăng dần theo chiều tăng của điện tích hạt nhân do đó bán kính Na < Mg < Si
Do đó thứ tự năng lượng ion hoá thứ nhất giảm dần là: C, Si, Mg, Na

\(n_{H_2SO_4}=0,5.0,2=0,1\left(mol\right)\\ n_{HCl}=0,2.2,5=0,5\left(mol\right)\\ n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ n_{H^+}=2n_{H_2SO_4}+n_{HCl}=0,7\left(mol\right)\)
Giả sử kim loại dư
\(\Rightarrow n_{H_2}=\dfrac{1}{2}\Sigma n_{H^+}=\dfrac{1}{2}.0,7=0,35\left(mol\right)>0,25\left(mol\right)\)
Vậy kim loại hết
Đặt \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow24x+27y=5,1\left(g\right)\) (I)
BT e:
cho:
\(Mg^o\rightarrow Mg^{2+}+2e\)
x------------------>2x
\(Al^o\rightarrow Al^{3+}+3e\)
y--------------->3y
nhận:
\(2H^++2e\rightarrow H_2O\)
0,5<--0,25
Từ trên có: \(2x+3y=0,5\left(II\right)\)
Từ (I), (II) giải được \(\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(CM_{H^+.dư}=\dfrac{0,7-0,5}{0,2}=1M\)
\(CM_{Mg^{2+}}=CM_{Al^{3+}}=\dfrac{0,1}{0,2}=0,5M\)
\(CM_{SO_4^{2-}}=0,5M\\ CM_{Cl^-}=2,5M\)
Phân tử khối của NaCl = 23 + 35,5 = 58,5 (g/mol)
58,5 gam muối ăn có 23 gam ion Na+
5 gam muối ăn có a gam ion Na+
=> a = 5 x 23 : 58,5 = 1,965 gam = 1965 mg
Ta có: 500 < 1965 < 2 300
=> Nếu một người sử dụng 5,0 gam muối ăn mỗi ngày thì lượng ion Na+ mà người ấy nạp vào cơ thể không vượt mức giới hạn cho phép