Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Phản ứng xảy ra hoàn toàn, chất rắn sau phản ứng + NaOH thu được khí H2 => chứng tỏ có Al dư sau phản ứng => phản ứng nhiệt nhôm oxit sắt hết. Chất rắn Y gồm có Al2O3, Fe và Al dư
Phần 2: nFe = 16,8 : 56 = 0,3 (mol) ;
Bảo toàn e => 3nAl dư = 2 nH2 => nAl = 2/3. nH2 = a (mol)
Phần 1: Nếu không tạo muối NH4NO3 thì ne ( Fe, Al dư) nhường = ne (NO nhận)
=> 0,3. 3 + 3a = 3a => vô lí
Vậy phải tạo muối NH4NO3
=> nNH4NO3 = ( 3nFe + 3nAl – 3nNO)/8 = ( 0,3. 3+ 3a – 3a) /8 = 0,1125 (mol)
mmuối = mFe(NO3)3 + mAl(no3)3 + mNH4NO3
=> mAl(NO3)3 = 233,7 – 0,3. 242 – 0,1125.80 = 152, 1(g)
nAl(NO3)3 ≈ 0,714 (mol)
Rắn Y phản ứng vừa đủ với dd NaOH
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al + NaOH → NaAlO2 + 3/2H2
=> nNaOH = nNaAlO2- = nAl(NO3)3 = 0,714 (mol) ( Bảo toàn nguyên tố Al)
=> VNaOH = 0,714: 2 = 0,357 (lít) = 357 (ml)
Gần nhất với 352 ml
Đáp án D

Đáp án A
Ta có khối lượng mỗi phần là 30,66 gam.
Cho phần một tác dụng với NaOH dư thu được 0,09 mol H2 do vậy trong X chứa Al dư.
Vậy trong mỗi phần chứa Fe, Al2O3 và Al dư 0,06 mol.
Cho phần 2 tác dụng với 1,74 mol HNO3 thu được 0,18 mol NO. Cô cạn dung dịch Y thu được các muối, nung rắn tới khối lượng không đổi thu được rắn chứa Al2O3 và Fe2O3 có số mol bằng nhau.
Gọi số mol của Fe, Al2O3 trong mỗi phần lần lượt là a, b
![]()
Và a=2b+0,06
Giải hệ: a=0,3; b=0,12.
Gọi x là số mol NH4NO3 có thể tạo ra.
Bảo toàn N:
n N O 3 - t r o n g m u o i K l = 1 , 74 - 0 , 18 - 2 x = 1 , 56 - 2 x
Bảo toàn e: 1 , 56 - 2 x = 0 , 12 . 6 + 0 , 18 . 3 + 8 x
Vậy NO3– trong muối là 1,5 mol.
Muối trong Y gồm Al(NO3)3 0,3 mol, Fe(NO3)2 0,3 mol và NH4NO3 0,03 mol.
Cho Y tác dụng với Na2CO3 dư thu được kết tủa là Al(OH)3 0,3 mol và FeCO3 0,3 mol.
→ a = 58 , 2 g

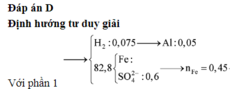
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D

Giải thích:
Phần 1:
nH2 = 0,075 => nAldư = 0,05
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
8x→ 3x →4x → 9x
Chất rắn không tan trong NaOH là Fe (9x mol). Với H2SO4 đặc nóng
=> Fe3+ (u) và Fe2+ (v)
Bảo toàn electron: 3u + 2v = 0,6 . 2
m muối = 400a/2 + 152b = 82,8
=> u = 0,3 và v = 0,15
=> 9x = u + v => x = 0,05
Vậy phần 1 chứa Al (0,05), Al2O3 (0,2) và Fe (0,45)
=> mPhần 1 = 46,95
=> mPhần 2 = mX - mPhần 1 = 187,8
=> mPhần 2 = 4mPhần 1
Vậy phần 2 chứa các chất có số mol gấp 4 phần 1.
Phần 2 chứa Al (0,2), Al2O3 (0,8) và Fe (1,8)
=> nO = 0,8 . 3 = 2,4
nH+ = 12,97 = 4nNO + 2nNO2 + 2nO + 10nNH4+
=> nNH4+ = 0,015
Dung dịch A chứa Fe3+ (a mol), Fe2+ (y mol) và các ion khác.
Bảo toàn Fe => a + b = 1,8
Bảo toàn electron => 3a + 2b + 0,2 . 3 = 1,25 . 3 + 1,51 + 0,015 . 8
=> a = 1,18 và b = 0,62
Đáp án D

Giải thích:
Các phản ứng xảy ra hoàn toàn. Hỗn hợp rắn Y + NaOH thấy có H2 thoát ra => Al dư sau phản ứng nhiệt nhôm
Vậy hỗn hợp Y gồm Al2O3, Fe và Al dư
Phần 1: Bảo toàn e => nAl dư = 2/3nH2 = 2/3. 0,45 = 0,3 (mol)
Phần 2: Bảo toàn e: 3nFe + 3nAl dư = 3nNO => nFe = (3.0,7 – 3.0,3)/3 = 0,4 (mol)
=> m = mFe = 0,4. 56 = 22,4 (g)
Đáp án B

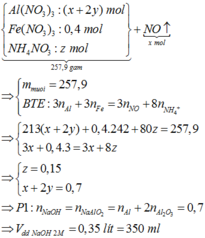
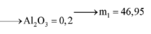
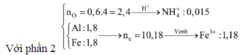
Đáp án cần chọn là: B