

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



a)
\(n_{CH_4}=n_{C_xH_y}=\dfrac{0,5}{22,4}\left(mol\right)\)
=> \(\dfrac{0,5}{22,4}.16+\dfrac{0,5}{22,4}.M_{C_xH_y}=0,9375\)
=> MCxHy = 26 (g/mol)
=> x = 2, y = 2 thỏa mãn
CTPT: C2H2
b)
\(n_{C_2H_2}=\dfrac{\dfrac{8,96}{2}}{22,4}=0,2\left(mol\right)\)
x = mtăng = mC2H2 = 0,2.26 = 5,2 (g)
PTHH: C2H2 + 2Br2 --> C2H2Br4
0,2----->0,4
=> nBr2(tt) = \(\dfrac{0,4.120}{100}=0,48\left(mol\right)\)
=> \(V_{dd.Br_2}=\dfrac{0,48}{2}=0,24\left(l\right)\)
c) \(n_{CH_4}=n_{C_2H_2}=0,2\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,2--->0,4
=> VO2 = 0,4.22,4 = 8,96 (l)
=> Vkk = 8,96 : 20% = 44,8 (l)

Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng :
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH 4 và C n H 2 n + 2
Theo đề bài V C 2 H 2 tham gia phản ứng là : 0,896 - 0,448 = 0,448 (lít).
Vậy số mol C 2 H 2 là 0,448/22,4 = 0,02 mol
Gọi số mol của CH 4 là X. Theo bài => số mol của C n H 2 n + 2 cũng là x.
Vậy ta có : x + x = 0,448/22,4 = 0,02 => x = 0,01
Phương trình hoá học của phản ứng đốt cháy hỗn hợp :
2 C 2 H 2 + 5 O 2 → 4 CO 2 + 2 H 2 O
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
2 C n H 2 n + 2 + (3n+1) O 2 → 2n CO 2 + 2(n+1) H 2 O
Vậy ta có : n CO 2 = 0,04 + 0,01 + 0,01n = 3,08/44 => n = 2
Công thức phân tử của hiđrocacbon X là C 2 H 6

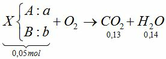
Đốt cháy ankin => nCO2 > nH2O mà theo bài ra nCO2 < nH2O
=> B là ankan nCO2 < nH2O
Nhận xét:
Đốt ankin: – nankin = nH2O – nCO2
Đốt ankan: nankan = nH2O – nCO2
=> b – a = 0,01 và b + a = 0,05
=> a = 0,02 và b = 0,03
=> số C trung bình = 2,6 và số H trung bình = 5,6
TH1: số C trong ankin < 2,6 => A là C2H2: 0,02 và B: 0,03
=> B: 44 (C3H8)
TH2: số C trong ankan < 2,6 => A : 0,02 và CH4: 0,03
=> A: 68 (C5H8) loại do hh khí
TH3: số C trong ankan < 2,6 => A: 0,02 và C2H6: 0,03
=> A: 47 (lẻ) => loại
Vậy A là C2H2 (axetilen/ etin) và B là C3H8 (propan)

có V khí thoát ra = V CnH2n+2 = 2,016 lít
⇒ nCnH2n+2 = 0,09 mol
có nhh =3,136/22,4 =0,14 mol
⇒ nCmH2m = 0,14- 0,09 = 0,05 mol
⇒ %V A = 0,09/0,15 .100% = 60%
%V B = 100% - 60% = 40%
có mdd brom tăng = mCmH2m = 1,4
có m CmH2m = 0,05.14m = 1,4
⇒ n = 2 ( C2H4)
Ca(OH)2 + CO2 ----> CaCO3 + H2O
0,17 0,17 (mol)
Ca(HCO3)2 --to--> CaCO3 + CO2 + H2O
0,05 0,05 (mol)
Ca(OH)2 + 2CO2 ----> Ca(HCO3)2
0,1 0,05 (mol)
⇒ nCO2 = 0,17 +0,1 = 0,27 mol
BTNT Với C :
CnH2n+2 -----> nCO2
0,09 0,09n (Mol)
⇒ 0,09n =0,27
⇒ n = 3
( C3H8)

Vì bài toán chỉ có số liệu tương đối (%) nên để đơn giản và không mất tính tổng quát, ta có thể chọn số mol một chất bất kì. Ta chọn nX = 1(mol)
![]()
Khi làm lạnh thì hơi nước ngưng tụ vậy Y chỉ chứa CO2 và O2 dư.
Pt:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
a → a(x + 0,25y) ax 0,5ay
dư: 1 – a – a(x + 0,25y)

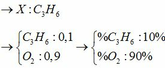

Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%