Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Thoạt nhìn đây có vẻ là một bài toán khó vì chỉ cho hai dữ liệu là số mol và dung dịch thu được chỉ chứa hai muốn sunfat. Ta cũng có thể bị mắc bẫy vì cho rằng nhưng công thức này chỉ áp dụng cho trường hợp kim loại phản ứng với HNO3. Tuy nhiên, đây là một bài toán khá đơn giản.
Vì dung dịch thu được chỉ chứa hai muối sunfat nên hết
![]()

Thoạt nhìn đây có vẻ là một bài toán khó vì chỉ cho hai dữ liệu là số mol và dung dịch thu được chỉ chứa hai muốn sunfat. Ta cũng có thể bị mắc bẫy vì cho rằng ![]() nhưng công thức này chỉ áp dụng cho trường hợp kim loại phản ứng với HNO3. Tuy nhiên, đây là một bài toán khá đơn giản.
nhưng công thức này chỉ áp dụng cho trường hợp kim loại phản ứng với HNO3. Tuy nhiên, đây là một bài toán khá đơn giản.
Vì dung dịch thu được chỉ chứa hai muối sunfat nên hết
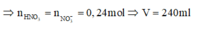

Coi hh X gồm Fe, Cu và O
Đặt \(n_{Fe\left(Fe_xO_y\right)}=a;n_{Cu}=b;n_{O\left(Fe_xO_y\right)}=c\) ( mol )
\(\Rightarrow m_{hh}=56a+64b+16c=14,64\left(g\right)\) (1)
\(m_{muối}=m_{Fe\left(NO_3\right)_3}+m_{Cu\left(NO_3\right)_2}=242a+188b=47,58\left(g\right)\) (2)
Bảo toàn e: \(3n_{Fe}+2n_{Cu}=2n_O+3n_{NO}=3a+2b=2c+3.0,09\) (3)
\(\left(1\right);\left(2\right);\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,15\\b=0,06\\c=0,15\end{matrix}\right.\)
\(\%m_{Cu}=\dfrac{0,06.64}{14,64}.100=26,22\%\)
\(\dfrac{x}{y}=\dfrac{0,15}{0,15}=\dfrac{1}{1}\Rightarrow CTHH:FeO\)

a)\(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}64x+27y=9,1\\BTe:2x+3y=0,5\cdot1\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Cu}=\dfrac{0,1\cdot64}{9,1}\cdot100\%=70,33\%\)
\(\%m_{Al}=100-70,33\%=29,67\%\)
b)\(\left\{{}\begin{matrix}n_{NO_2}+n_{NO}=0,5\\\dfrac{n_{NO_2}}{n_{NO}}=\dfrac{2}{1}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{NO_2}=\dfrac{1}{3}\\n_{NO}=\dfrac{1}{6}\end{matrix}\right.\)
Gọi \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}64a+27b=9,1\\BTe:2x+3y=\dfrac{1}{3}\cdot1+\dfrac{1}{6}\cdot3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=\dfrac{4}{115}\\b=\dfrac{527}{2070}\end{matrix}\right.\)
\(\%m_{Cu}=\dfrac{\dfrac{4}{115}\cdot64}{9,1}\cdot100\%=24,46\%\)
\(\%m_{Al}=100\%-24,46\%=75,54\%\)
\(n_{HNO_3}=2n_{NO_2}+4n_{NO}=2\cdot\dfrac{1}{3}+4\cdot\dfrac{1}{6}=\dfrac{4}{3}mol\)

Coi \(n_{Cu} = n_{FeO} = 1(mol)\\ n_{Fe} = x(mol)\)
Bảo toàn electron cho quá trình 1:
\(2n_{Fe} + 2n_{Cu} = 3n_{NO}\)
⇒ 2x + 2 = 3a(1)
Y gồm \(Cu(NO_3)_2,Fe(NO_3)_2\)
Bảo toàn electron cho quá trình 2 :
\(n_{Fe(NO_3)_2} = x + 1 = 3n_{NO}\)
⇒ x + 1 = 3b(2)
Lấy (1) : (2), ta có \(\dfrac{2x + 2}{x + 1} =\dfrac{3a}{3b} \Rightarrow \dfrac{a}{b} = 2\)

a. Gọi \(a,b\) lần lượt là số mol của \(Mg,Fe\) có trong hỗn hợp ban đầu.
\(\Rightarrow m_{hh}=24a+56b=22,8\left(g\right)\left(1\right)\)
\(n_{SO_2}=\frac{15,68}{22,4}=0,7\left(mol\right)\)
Các quá trình oxi hóa và khử:
\(Mg\rightarrow Mg^{2+}+2e\)
\(a----->2a\)
\(Fe\rightarrow Fe^{3+}+3e\)
\(b----->3b\)
\(S^{+6}+2e\rightarrow S^{+4}\)
\(0,7-1,4-0,7\)
Áp dung định luật bào toàn electron, ta có: \(2a+3b=1,4\left(mol\right)\left(2\right)\)
Từ \(\left(1\right),\left(2\right)\) ta được hệ: \(\left\{{}\begin{matrix}24a+56b=22,8\\2a+3b=1,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,25\left(mol\right)\\b=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Mg}=0,25.24=6\left(g\right)\Rightarrow\%m_{Mg}=\frac{6}{22,8}=.100\%=26,32\%\)
\(\Rightarrow\%m_{Fe}=100\%-26,32\%=73,68\%\)
b. Từ câu a, ta được: \(n_{H_2SO_4\left(p.ư\right)}=n_{S^{+6}}=0,7\left(mol\right)\)
\(n_{NaOH}=0,4.3=1,2\left(mol\right)\)
PTHH: \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\frac{1,2}{2}=0,6\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(bđ\right)}=0,7+0,6=1,3\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(bđ\right)}=1,3.98=127,4\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4\left(bđ\right)}=\frac{127,4.100}{98}=130\left(g\right)\)
c. Gọi \(x\) là số mol của \(Cu_2S\) \(\rightarrow n_{FeS_2}=2x\left(mol\right)\)
PTHH:
\(2FeS_2+14H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+14H_2O+15SO_2\)
\(2x---->14x-->x\)
\(Cu_2S+6H_2SO_4\rightarrow2CuSO_4+5SO_2+6H_2O\)
\(x---->6x-->2x\)
\(\Rightarrow14x+6x=1,3\left(mol\right)\Leftrightarrow x=0,065\left(mol\right)\)
\(\Rightarrow n_{Fe_2\left(SO_4\right)_3}=x=0,065\left(mol\right);n_{CuSO_4}=2x=0,13\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,065.400=26\left(g\right);m_{CuSO_4}=0,13.160=20,8\left(g\right)\)
\(\Rightarrow m\)muối\(=26+20,8=46,8\left(g\right)\)