Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
Gọi công thức chung của kim loại trong hỗn hợp A là X
\(\text{X + 2HCl → 2XCl + H2 ↑}\)
\(\text{nHCl = 0,2.3,5 = 0,7 mol}\)
\(\text{nH2 = 6,72:22,4= 0,3 mol}\)
nHCl > 2nH2 → HCl dư
\(\text{nX = nH2 = 0,2 mol}\)
\(\overline{M}=\frac{12}{0,3}=40\)
M Fe = 56>40 → M M <40
\(\text{M + H2SO4 → MSO4 + H2 ↑}\)
\(\text{nH2SO4 = 0,2.2 = 0.4 mol}\)
H2SO4 dư nên nM< 0,4 →M M> 3,6:0,4=9
9<M<40 → M là Magie (M Mg = 24)
\(\text{m agno3 đã pư=80%.20=16g}\)
\(\text{n agno3 pư=0,1 mol}\)
cu+2agno3->cu(no3)2+2ag
\(\text{0,05 .. 0,1 .. 0,05 .. 0,1 mol}\)
\(\text{vậy m vật sau pư=m vật ban đầu-m cu pư+m ag bám vào=12,6g}\)
\(\text{m dd sau pư=m dd trước+m cu-m ag pư=492,4g}\)
\(\text{C% agno3=0,8%}\)
\(\text{C%(cu(no3)2)=1,9%}\)

Bài 1 :
nFe = 0,25 mol; nAgNO3 = 0,2 mol; nCu(NO3)2 = 0,05 mol.
Giữa Ag+ và Cu2+ thì Ag+ có tính oxi hóa mạnh hơn Cu2+, nên Ag+ tham gia phản ứng với Fe trước, sau khi Ag+ tham gia phản ứng hết nếu còn dư Fe thì Cu2+ mới tiếp tục tham gia.
Fe + 2Ag+ → Fe2+ + 2Ag (VII)
nFe = 0,25 mol; nAg+ = 0,2 mol → Fe dư sau phản ứng (VII)
Fe + 2Ag+ → Fe2+ +2Ag
0,1 (mol) 0,2 (mol) 0,1 (mol) 0,2 (mol)
Sau phản ứng (VII) ta có: nFe còn = 0,25 – 0,1 = 0,15 mol, Ag tạo thành = 0,2 mol.
Fe + Cu2+ → Fe2+ + Cu (VIII)
nFe = 0,15 mol; nCu2+ = 0,05 mol → Fe vẫn còn dư sau phản ứng (VIII)
Fe + Cu2+ → Fe2+ + Cu
0,05 (mol) 0,05 (mol) 0,05 (mol) 0,05 (mol)
Vậy, sau phản ứng (VII) và (VIII), chất rắn thu được gồm nAg = 0,2 mol; nCu = 0,05 mol và nFe dư = 0,25 – (0,1 + 0,05) = 0,1 mol.
Nên ta có giá trị của m = mAg + mCu + mFe dư
= 0,2.108 + 0,05.64 + 0,1.56 = 30,4 gam.
Bài 2 :
Nhận xét :
- Mg sẽ tác dụng với AgNO3 trước, sau khi AgNO3 hết thì Mg mới phản ứng với Cu(NO3)2.
- Vì chưa biết khối lượng Mg tham gia là bao nhiêu, nên bài toán này ta phải chia ra các trường hợp:
+ Mg tham gia vừa đủ với AgNO3, Cu(NO3)2 chưa tham gia, chất rắn thu được là Ag tính được giá trị m1.
+ AgNO3, Cu(NO3)2 tham gia hết, Mg phản ứng vừa đủ, chất rắn tham gia gồm Ag, Cu có giá trị là m2.
Nếu khối lượng chất rắn trong 2 trường hợp nằm trong khoảng m1< 17,2 < m2 (từ dữ kiện đề bài, tính toán giá trị m1, m2) có nghĩa là Ag+ tham gia phản ứng hết, Cu2+ tham gia một phần.
Đáp số : m = 3,6gam.

\(2A+nCI2\rightarrow2ACIn\)
\(nA=\frac{1.96}{M}\)
\(nACI2=\frac{5,6875}{\left(M+35,5n\right)}\)
\(nA=nACI2\)
\(\Rightarrow\frac{1,96}{M}=\frac{5,6875}{\left(M+35,5n\right)}\)
\(\Rightarrow M=\frac{56}{3n}\)
\(\Rightarrow n=1\) \(M=\frac{56}{3}\left(Loại\right)\)
\(n=2\) \(M=\frac{112}{3}\left(Loại\right)\)
\(n=3\) \(M=56\)
Vậy A là Fe
\(Fe+HCI\rightarrow FeCI2+H2\)
\(FexOy+\frac{HCI\rightarrow FeCI2y}{x+H2O}\)
\(FexOy+H2\rightarrow Fe+H2O\)
Goi a b lần lượt là số mol của Fe và FexOy trong 4,6 gam hỗn hợp
\(nFe=a\Rightarrow nHCI=2a\)
\(nFexOy=b\Rightarrow nHCI=2by\)
\(nHCI=0,08\cdot2=1,6mol\)
\(\Rightarrow2a+2by=0,16\)
\(\Rightarrow a+by=0,08\left(1\right)\)
\(56a+b\left(56x+16y\right)=4,6\Rightarrow56a+56bx+16by=4,6\left(2\right)\)
Chất rắn X là Fe
\(nFexOy=b\)
=> nFe sinh ra là bx
\(\Rightarrow56a+56bx=3,64\left(3\right)\)
Từ (1) (2) và (3) ta có hệ:
\(\begin{cases}a+by=0,08\\56a+56bx+16by=4,6\\56a+56bx=3,64\end{cases}\)
\(a=0,02\\
bx=0,045\\
by=0,06\)
\(\frac{\Rightarrow bx}{by}=\frac{x}{y}=\frac{0,045}{0,06}=\frac{3}{4}\)
=> Công thức của oxit cần tìm là: Fe3O4
2A+nCl2 -------------->2ACln
nA=1.96/M
nACl2=5,6875/(M+35,5n)
nA=nACl2
=> 1,96/M=5,6875/(M+35,5n)
=>M=56/3n
=> n=1 M=56/3 (Loại)
n=2 M=112/3 (Loại)
n=3 M=56
Vậy A là Fe
Fe+HCl--->FeCl2+H2
FexOy+HCl---->FeCl2y/x+H2O
FexOy+H2---->Fe+H2O
Goi a b lần lượt là số mol của Fe và FexOy trong 4,6 gam hỗn hợp
nFe=a=>nHCl=2a
nFexOy=b=>nHcl=2by
nHCl=0,08*2=1,6 mol
=> 2a+2by=0,16
=> a+by=0,08 (1)
56a+b(56x+16y)=4,6=> 56a+56bx+16by=4,6 (2)
Chất rắn X là Fe
nFexOy=b
=> nFe sinh ra là bx
=> 56a+56bx=3,64 (3)
Từ (1) (2) và (3) ta có hệ:
{a+by=0,08
{56a+56bx+16by=4,6
{56a+56bx=3,64
a=0,02
bx=0,045
by=0,06
=> bx/by=x/y=0,045/0,06=3/4
=> Công thức của oxit cần tìm là: Fe3O4

Do sau phản ứng là hh chất rắn nên Mg dư, FeCl3 hết
PTHH
Mg + 2FeCl3 --> MgCl2 + 2FeCl2
x 2x 2x
Mg + FeCl2 --> MgCl2 + Fe
2x 2x 2x
3Mg + 2FeCl3 --> 3MgCl2 + 2Fe
y 2/3y 2/3y
Theo PTHH ta có: nFeCl3 = nFe = 0.2
2nMg = 3nFe = 0.3
nMg = nMgCl2 = 0.3
Nồng độ mol của các chất trong hh:
CmFeCl2 = 0.2/0.4 = 0.5M
CmMgCl2 = 0.3/0.4 = 0.75M
PTHH
Fe + 2HCl --> FeCl2 + H2
0.2 0.4
Mg + 2HCl --> MgCl2 + H2
0.3 0.6
Khối lượng HCl cần dùng: m = 1*36.5 = 36.5g
với lại bài này có cho Mg tác dụng với FeCl2 hay là chỉ cho tác dụng với FeCl3 với lại cho mình bik vì sao khi làm nhớ giải thích giùm mình nhé thank you

Số mol HCl = 3,5 . 0,2 = 0,7 mol
Gọi x, y là số mol của CuO và Fe2O3
a) CuO + 2HCl → CuCl2 + H2O
Phản ứng x → 2x x (mol)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Phản ứng: y → 6y 2y (mol)
Theo khối lượng hỗn hợp hai oxit và theo số mol HCl phản ứng, ta lập được hệ phương trình đại số:
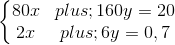
Giải phương trình (1) (2) ta được x = 0,05 mol; y = 0,1 mol
b) mCuO = 0,05 . 160 = 4 g
m Fe2O3 = 20 – 4 = 16 g
\(2HCl+CuO\rightarrow CuCl_2+H_2O \)
2 : 1 : 1 : 1
2x \(\leftarrow\)80x
\(6HCl+Fe_2O_3\rightarrow2FeCl_3+3H_2O\)
6 : 1 : 2 : 3
6y \(\leftarrow\)160y
\(n_{HCl}=3,5.0,2=0,7\left(mol\right)\)
gọi \(n_{CuO}\)là x còn \(n_{Fe_2O_3}\)là y
suy ra \(m_{CuO}=80x\),\(m_{Fe_2O_3}\)=160y
ta có: 80x+160y=20g
x+y =0,7mol
\(\Rightarrow x=0,05,y=0,1\)
\(\Rightarrow m_{CuO}=0,05.80=4\left(g\right)\)
\(m_{Fe_2O_3}=0,1.160=16\left(g\right)\)

Hỗn hợp A gồm 0,56 g Fe và 16 g Fe2O3.Trộn A với m gam bột nhôm rồi nungở nhiệt độ cao (không có không khí), thu được hỗn hợp D. Nếu cho D tan trong dung dịch H2SO4loãng dư thì thu được a lít khí, nhưng cho D tác dụng với dung dịch NaOH (dư) thì thể tích khí thu được là 0,25a lít (trong cùng điều kiện). Khoảng giá trị của m là
A. 0,54 < m < 2,70. B. 2,7 < m < 5,4.
C. 0,06 < m < 6,66. D. 0,06 < m < 5,4.
nFe = 0.01
nFe2O3 = 0.1
Gọi hiệu suất pứ nhiệt nhôm là h ( 0 < h < 1 )
h = 0
=> Al chưa pứ
nH2 do Fe sinh ra = (a - 0.25a)/22.4 = 0.01
=> a = 112/375
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => m = 0.06
h =1 :
Al dư,Fe2O3 hết
nAl pứ = 2nFe2O3 = 0.2
=> nFe = 0.1*2 + 0.01 = 0.21
nH2 do fe sinh ra = (a - 0.25a)/22.4 = 0.21
=> a = 6.272
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => nAl ban dầu = 5a/672 + 0.2 = 0.74/3
=> m = 6.66g
=> C 0,06 < m < 6,66
Chọn A
gọi x, y lần lượt là số mol của CuO và F e 2 O 3