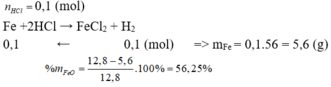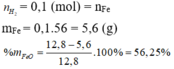Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Mol: x 3x
PTHH: CuO + H2SO4 → CuSO4 + H2O
Mol: y y
Ta có: \(\left\{{}\begin{matrix}160x+80y=16\\3x+y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0\\y=0,2\end{matrix}\right.\)
\(\Rightarrow\%m_{CuO}=100\%;\%m_{Fe_2O_3}=0\%\)
Thấy đề nó sai sai

a) \(2Fe+6H_2SO_4\text{đặc}\rightarrow^{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(2FeO+4H_2SO_4\text{đặc}\rightarrow^{t^0}Fe_2\left(SO_4\right)_3+SO_2+4H_2O\)
\(2Fe_3O_4+10H_2SO_4\text{đặc}\rightarrow3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\)
Quy đổi hỗn hợp A gồm x mol Fe và y mol O
\(\Rightarrow56x+16y=49,6\) (1)
\(Fe\rightarrow Fe^{3+}+3e\)
x ------------> 3x
\(S^{+6}+2e\rightarrow S^{+4}\)
..........0,8 <--- 0,4
\(O+2e\rightarrow O^{2-}\)
y --> 2y
\(\Rightarrow3x=2y+0,8\) (2)
Giải hệ (1)(2) được x = 0,7 mol, y = 0,65 mol
\(\Rightarrow\%m_O=\dfrac{16.0,65}{49,6}.100\%=20,97\%\)
Ta có:
\(2H_2SO_4+2e\rightarrow SO_4^{2-}+SO_2\uparrow+2H_2O\)
...............................0,4 <---- 0,4
\(\Rightarrow n_{SO_4^{2-}}\text{tạo muối với cation kim loại}=0,4\) mol
\(\Rightarrow m_{\text{muối}}=m_{\text{kim loại}}+m_{SO_4^{2-}}\text{tạo muối với cation kim loại}\)
\(=56.0,7+96.0,4=77,6\) gam

a) Gọi số mol Mg, Fe là a, b (mol)
=> 24a + 56b = 11,84
\(n_{HCl}=\dfrac{146.14\%}{36,5}=0,56\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
a--->2a--------->a----->a
Fe + 2HCl --> FeCl2 + H2
b-->2b-------->b------>b
=> 2a + 2b = 0,56
=> a = 0,12; b = 0,16
=> \(\left\{{}\begin{matrix}\%Mg=\dfrac{0,12.24}{11,84}.100\%=24,324\%\\\%Fe=\dfrac{0,16.56}{11,84}.100\%=75,676\%\end{matrix}\right.\)
b) \(n_{H_2}=a+b=0,28\left(mol\right)\)
=> \(V_{H_2}=0,28.22,4=6,272\left(l\right)\)
c) mdd sau pư = 11,84 + 146 - 0,28.2 = 157,28 (g)
=> \(\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{0,12.95}{157,28}.100\%=7,25\%\\C\%_{FeCl_2}=\dfrac{0,16.127}{157,28}.100\%=12,92\%\end{matrix}\right.\)

nH2=6,72/22,4=0,3 mol
Mg + 2HCl \(\rightarrow\) MgCl + H2
a a mol
Fe + 2HCl \(\rightarrow\) FeCl2 +H2
b b mol
ta có 24a + 56b =13,6
và a + b=0,3
=>a=0,1 mol , b=0,2 mol
=>mMg=0,2*24=2,4 g
=>%Mg=2,48100/13,6=17,65%
=>%Fe=100-17,65=82,35%
nMgCl2=nMg=0,1mol=>mMgCl2=0,1*95=9,5 g
nFeCl2=nFe=0,2 mol=>mFeCl2 = 0,2*127=25,4 g
nHCl=nMg+nFe=0,1+0,2=0,3mol
=>CMHCl=0,3/0,4=0,75M

a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$FeO + H_2SO_4 \to FeSO_4 + H_2O$
$FeSO_4 + 7H_2O \to FeSO_4.7H_2O$
b)
n Fe = a(mol) ; n FeO = b(mol)
=> 56a + 72b = 54,4(1)
Theo PTHH :
n FeSO4.7H2O = a + b = 222,4/278 = 0,8(2)
Từ (1)(2) suy ra a = 0,2 ; b = 0,6
Suy ra :
%m Fe = 0,2.56/54,4 .100% = 20,59%
%m FeO = 100% -20,59% = 79,41%