Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.Ta có n HCl = 1 . 0,25 = 0,25 mol
nH2SO4 = 0,5.0.25 = 0,125 mol
==> nH(X) = 0,25 + 0,125.2 = 0,5 mol
nH2 = 4,368/22,4 = 0,195 mol <=> nH= 0,195. 2 = 0,39 mol < 0,5 mol
Vậy sau phản ứng dung dịch B vẫn còn axit dư
b. Gọi số mol của Al và Mg lần lượt là x và y mol
Ta có phương trình 27x + 24y =3,87 (1)
Áp dụng định luật bảo toàn eletron ==> 3x + 2y = 0,195.2 (2)
Từ (1) , (2) ==> \(\left\{{}\begin{matrix}x=0,09\\y=0,06\end{matrix}\right.\)
mAl = 0,09 .27 = 2,43 gam , %mAl trong A = \(\dfrac{2,43}{3,87}\).100=62,8%
==> %mMg trong A = 100 - 62,8 = 37,2%

nHCl = 0,5.1,4 = 0,7 (mol) ; nH2SO4 = 0,5.0,5 = 0,25 (mol) => nSO42- = nH2SO4 = 0,25 (mol)
∑ nH+ = nHCl + 2nH2SO4 = 0,7 + 2.0,25 = 1,2 (mol)
nNaOH = 2V (mol) ; nBa(OH)2 = 4V (mol)
∑ nOH- = nNaOH + 2nBa(OH)2 = 2V + 2.4V = 10V (mol)
Các PTHH xảy ra:
H+ + OH- → H2O (1)
Ba2+ + SO42- → BaSO4↓ (2)
Khi cho Zn vào dd C thấy có khí H2 thoát ra => có 2 trường hợp có thể xảy ra. Zn có thể bị hòa tan bởi dung dịch axit hoặc bazo
nH2 = 3,36 : 22,4 = 0,15 (mol)
TH1: dd C có chứa H+ dư => phản ứng (1) OH- phản ứng hết
Zn + 2H+ → Zn2+ + H2↑ (3)
0,3 ← 0,15 (mol)
=> nH+ (1) = ∑ nH+ - nH+ dư = 1,2 – 0,3 = 0,9 (mol)
Theo (1): ∑nOH- = nH+ (1) = 0,9 = 10V => V = 0,09 (lít)
nBa(OH)2 = 4.0,09 = 0,36 => nBa2+ = nBa(OH)2 = 0,36 (mol) > nSO42-
Từ PTHH (2) => nBaSO4 = nSO42- = 0,25 (mol) => mBaSO4 = 0,25.233 = 58,25(g)
TH2: dd C có chứa OH- dư => phản ứng (1) H+ phản ứng hết
Zn + 2OH- → ZnO22- + H2↑ (4)
0,3 ← 0,15 (mol)
=> ∑ nOH- = nOH-(1) + nOH- (4) = 1,2 + 0,3 = 1,5 (mol)
=> 10V = 1,5
=> V = 0,15 (lít)
=> nBa(OH)2 = 0,15. 4 = 0,6 (mol)
=> nBa2+ = 0,6 (mol) > nSO42- = 0,25 (mol)
=> mBaSO4 = 0,25.233 = 58,25 (g)

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
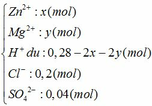
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
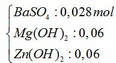
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

a) Mg + 2HCl → MgCl2 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
nHCl = 0,5 . 1 = 0,5 mol
nH2SO4 = 0,28 . 0,5 = 0,14 mol
nH2 =\(\frac{8,736}{22,4}\) = 0,39 mol
Nhận thấy nHCl + 2nH2SO4 = 2nH2
→ Hỗn hợp axit phản ứng vừa đủ
Bảo toàn nguyên tố Cl: nCl = nHCl = 0,5 mol
Bảo toàn gốc SO4: nSO4 = nH2SO4 = 0,14 mol
m muối = mKL + mCl + mSO4
= 7,74 + 0,5 . 35,5 + 0,14 . 96
= 38,93 (g)
b)
nKOH = V . 1 = V (mol)
nBa(OH)2 = 0,5V (mol)
Để lượng kết tủa là lớn nhất thì nKOH + 2.nBa(OH)2 = nHCl + 2.nH2SO4
→ V + 2 . 0,5V = 0,5 + 2 . 0,14

1/ nH2 = 0,39 mol; nHCl = 0,5 mol; nH2SO4 = 0,14 mol
nH+= 0,5 + 0,14.2 = 0,78 = 2nH2
=> axit phản ứng vừa đủ
Bảo toàn khối lượng: mkim loại + mHCl + mH2SO4 = mmuối khan + mH2
=> mmuối khan = 7,74 + 0,5.36,5 + 0,14.98 – 0,39.2 = 38,93 gam
2/ Đặt x, y là số mol Mg, Al
\(\left\{{}\begin{matrix}24x+27y=7,74\\x+\dfrac{3}{2}y=0,39\end{matrix}\right.\)
=> x=0,12 ; y=0,18
Để thu được kết tủa lớn nhất thì Al(OH)3 không bị tan trong NaOH
Dung dịch A : Mg2+ (0,12 mol) , Al3+ (0,18 mol)
\(Mg^{2+}+2OH^-\rightarrow Mg\left(OH\right)_2\)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
=> \(n_{OH^-}=n_{NaOH}=0,12.2+0,18.3=0,78\left(mol\right)\)
=> \(V_{NaOH}=\dfrac{0,78}{2}=0,39\left(lít\right)\)

\(n_{HCl}=0.5\cdot1=0.5\left(mol\right)\)
\(n_{H_2SO_4}=0.5\cdot0.28=0.14\left(mol\right)\)
\(\Rightarrow n_{H^+}=0.5+0.14\cdot2=0.75\left(mol\right)\)
\(n_{H_2}=\dfrac{8.736}{22.4}=0.39\left(mol\right)\)
\(Mg+2H^+\rightarrow Mg^{2+}+H_2\)
\(2Al+6H^+\rightarrow2Al^{3+}+3H_2\)
\(n_{H_2}>2n_{H^+}\)
=> Đề sai

tham khảo link bài làm
https://moon.vn/hoi-dap/cho-986-gam-hon-hop-gom-mg-va-zn-vao-mot-coc-chua-430-ml-dung-dich-h2so4-1m-sau-khi--330887

a) NH2SO4=0,14
NHCl=0,5
NH2=0,39
nH+=0,14.2+0,5=NH2
H+ hết
m muối =7,74+0,14.98+0,5.36,5-0,39.2=38,93
b) ddA gồm MgSO4 Al2(SO4)3
kết tủa lớn nhất khi kết tủa nhôm không bị tan trong dd kiềm và dd kiềm chỉ vừa đủ tạo thành kết tủa là Mg(OH)2 Al(OH3) BaSO4
Gọi số mol của Mg Al lần lượt là x,y ta có hệ
24x+27y=7,74 (1)
Theo pt ở đb có NH2=x+1.5y=0,39 (2)
Từ (1)(2 )có nMg=0,12 nAl=0,18
Al\(\rightarrow\)Al(OH3)
0,18\(\rightarrow\)0,18
Mg\(\rightarrow\)Mg(OH)2
0,12\(\rightarrow\) 0,12
Ba(OH)2 \(\rightarrow\)BaSO4
NH2SO4=nBaSO4=0,14
\(\rightarrow\)m kết tủa max= 0,14.233+0,18.78+0,12.58=53,62