Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 2:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ n_{Al}=\dfrac{2.0,6}{3}=0,4\left(mol\right)\\ \%m_{Al}=\dfrac{0,4.27}{12}.100\%=90\%\Rightarrow\%m_{Ag}=100\%-90\%=10\%\)
Câu 3:
\(n_{H_2}=\dfrac{0,6}{2}=0,3\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ n_{Al}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ n_{Al_2O_3}=\dfrac{25,8-0,2.27}{102}=0,2\left(mol\right)\\ n_{AlCl_3}=n_{Al}+2n_{Al_2O_3}=0,2+2.0,2=0,6\left(mol\right)\\ m_{AlCl_3}=133,5.0,6=80,1\left(g\right)\)

a) PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2 mol : 3 mol : 1 mol : 3 mol
0,1 mol <-- 0,15 mol <--- 0,15 mol
số mol của H2 là: 3,36 / 22,4 = 0,15 mol
khối lượng Al là: 0,1 * 27 = 2,7 g
ta có: 8 g chất rắn không tan sau phản ứng là: Cu
vậy khối lượng hỗn hợp a là: mAl + mCu = 2,7 + 8 = 10,7 g
b) khối lượng chất tan của H2SO4 là: mchất tan= 0,15 * 98 = 14,7 g
ta có: C% H2SO4= (mchất tan/ m dung dịch) * 100
→ m dung dịch H2SO4 = ( m chất tan * 100) / C% = ( 14,7 * 100) / 20= 73,5 g

a)
$Fe + 2HCl \to FeCl_2 + H_2$
b)
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{4,48}{22,4} = 0,2(mol)$
$m_{Fe} = 0,2.56 = 11,2(gam)$
$m_{Cu} = 17,6 - 11,2 = 6,4(gam)$
CTVVip ơi anh trả lời câu hỏi em mới đăng với ạ em cần gấp ạ

a. Đặt CTTQ của kim loại là R
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
b. \(n_{H_2}=\frac{22,4}{22,4}=1mol\)
\(n_R=\frac{65}{R}mol\)
Từ phương trình \(n_R=n_{H_2}\)
\(\rightarrow1=\frac{65}{R}\)
\(\rightarrow R=65\)
\(\rightarrow R:Zn\)
c. Từ phương trình \(n_{H_2SO_4}=n_{H_2}=1mol\)
\(m_{H_2SO_4}=1.98=98g\)
\(m_{ddH_2SO_4}=\frac{98}{35\%}=280g\)

Gọi x,y là số mol của AI và Fe
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
x --------------------... \(\frac{3x}{2}\)
Fe + H2SO4 -> FeSO4 + H2
y ----------------------> y
n H2 = 0,56 / 22,4 = 0,025 mol
Ta có hệ \(\begin{cases}27x+56y=0,83\\x+\frac{3x}{2}=0,025\end{cases}\)
\(\begin{cases}x=0,01mol\\y=0,01mol\end{cases}\)
=> m Al = 0,01 x 27 = 0,27 g
=> m Fe = 0,01 x 56 = 0,56 g
=> % Al = 0,27 / 0,83 x 100% = 32,53 %
=> % Fe = 0,56 / 0,83 x 100% = 67,47 %

Bài 1:
1. A đứng trước B trong dãy hoạt động hóa học
A, B tác dụng với H2SO4 loãng dư có chất rắn không tan là B. Chỉ có A tác dụng với H2SO4
mB = 6,45 - 3,2 = 3,2(g)
A + H2SO4 → ASO4 + H2↑
nH2 = 1,12 : 22,4 = 0,05 mol
Theo PTHH: nA = nH2 = 0,05 mol
mA + mB = 6,45g
mA = 6,45 - 3,2 = 3,25 (g)
\(M_A=\frac{3,25}{0,05}=65\)
→ A là kẽm
nAgNO3 = 0,5 . 0,2 = 0,1 mol
B + 2AgNO3 → B(NO3)2 + 2Ag↓
0,05___0,1_______0,05
\(M_B=\frac{3,2}{0,05}=64\)
→ B là đồng
2.
Dung dịch D có Cu(NO3)2 (0,05 mol)
Muối F là Cu(NO3)2 (0,05 mol)
Gọi số mol Cu(NO3)2 bị nhiệt phân là x
2Cu(NO3)2 (to)→ 2CuO + 4NO2 + O2
x → 2x →0,5x
mCu(NO3)2 ban đầu = mcr + mNO2 + mO2
→ 0,05 . 188 = 6,16 + 2x . 46 + 0,5x . 32
→ x = 0,03
Trong H gồm NO2 (0,06 mol); O2 (0,015 mol)
nH = 0,06 + 0,015 = 0,075 mol
VH2= 0,075 . 22,4 = 1,68 (l)
Bài 2:
a) RCO3 + H2SO4 → RSO4 + CO2↑ + H2O
\(n_{RCO3}=n_{RSO4}\)
\(\frac{23,2}{MR+60}=\frac{30,4}{MR+96}\)
\(\rightarrow MR=56\)
→ R là sắt
nCO2 = nFeCO3 = \(\frac{23,2}{112}\)= 0,2 mol
V CO2 = 0,2 . 22,4 = 4,48 (l)
b) Trong dung dịch thu được có 0,2 mol FeSO4
Zn + FeSO4 → ZnSO4 + Fe
0,2 ← 0,2 → 0,2
mthanh KL sau p.ứ = mZn ban đầu - mZn p.ứ + mFe
= 20 - 0,2 . 65 + 0,2 . 56
= 18,2 (g)

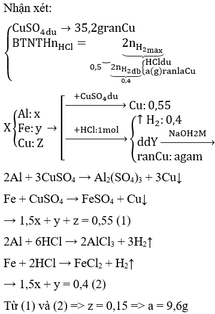
HS làm tương tự bài 3.
⇒ Chọn D.