Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

có vấn đề rồi. Muối tác dụng với muối tạo ra 2 muối mới làm gì có kim loại hở em!! Coi lại nha

Đồng nhất dữ kiện để thuận lợi cho tính toán, bằng cách nhân đôi khối lượng H2O.
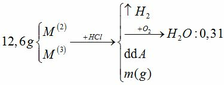
a.
BTNT H: nH2 = nH2O = 0,31 mol
=> nHCl = 0,62mol
BTKL: m kim loại + mHCl = mA + mB => 12,6 + 36,5 . 0,62 = m + 2 . 0,31 => m = 34,61g
b.
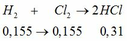
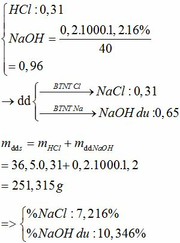


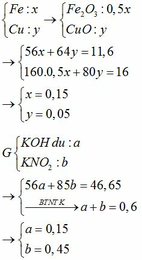
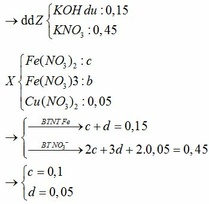

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
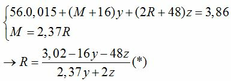
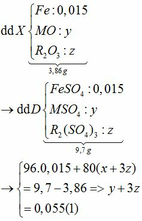
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

Câu 2:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ n_{Al}=\dfrac{2.0,6}{3}=0,4\left(mol\right)\\ \%m_{Al}=\dfrac{0,4.27}{12}.100\%=90\%\Rightarrow\%m_{Ag}=100\%-90\%=10\%\)
Câu 3:
\(n_{H_2}=\dfrac{0,6}{2}=0,3\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ n_{Al}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ n_{Al_2O_3}=\dfrac{25,8-0,2.27}{102}=0,2\left(mol\right)\\ n_{AlCl_3}=n_{Al}+2n_{Al_2O_3}=0,2+2.0,2=0,6\left(mol\right)\\ m_{AlCl_3}=133,5.0,6=80,1\left(g\right)\)



Bài 1:
1. A đứng trước B trong dãy hoạt động hóa học
A, B tác dụng với H2SO4 loãng dư có chất rắn không tan là B. Chỉ có A tác dụng với H2SO4
mB = 6,45 - 3,2 = 3,2(g)
A + H2SO4 → ASO4 + H2↑
nH2 = 1,12 : 22,4 = 0,05 mol
Theo PTHH: nA = nH2 = 0,05 mol
mA + mB = 6,45g
mA = 6,45 - 3,2 = 3,25 (g)
\(M_A=\frac{3,25}{0,05}=65\)
→ A là kẽm
nAgNO3 = 0,5 . 0,2 = 0,1 mol
B + 2AgNO3 → B(NO3)2 + 2Ag↓
0,05___0,1_______0,05
\(M_B=\frac{3,2}{0,05}=64\)
→ B là đồng
2.
Dung dịch D có Cu(NO3)2 (0,05 mol)
Muối F là Cu(NO3)2 (0,05 mol)
Gọi số mol Cu(NO3)2 bị nhiệt phân là x
2Cu(NO3)2 (to)→ 2CuO + 4NO2 + O2
x → 2x →0,5x
mCu(NO3)2 ban đầu = mcr + mNO2 + mO2
→ 0,05 . 188 = 6,16 + 2x . 46 + 0,5x . 32
→ x = 0,03
Trong H gồm NO2 (0,06 mol); O2 (0,015 mol)
nH = 0,06 + 0,015 = 0,075 mol
VH2= 0,075 . 22,4 = 1,68 (l)
Bài 2:
a) RCO3 + H2SO4 → RSO4 + CO2↑ + H2O
\(n_{RCO3}=n_{RSO4}\)
\(\frac{23,2}{MR+60}=\frac{30,4}{MR+96}\)
\(\rightarrow MR=56\)
→ R là sắt
nCO2 = nFeCO3 = \(\frac{23,2}{112}\)= 0,2 mol
V CO2 = 0,2 . 22,4 = 4,48 (l)
b) Trong dung dịch thu được có 0,2 mol FeSO4
Zn + FeSO4 → ZnSO4 + Fe
0,2 ← 0,2 → 0,2
mthanh KL sau p.ứ = mZn ban đầu - mZn p.ứ + mFe
= 20 - 0,2 . 65 + 0,2 . 56
= 18,2 (g)