Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Để dung dịch tồn tại thì ion Y2- là SO42-
Theo định luật bảo toàn điện tích: 0,1.1+ 0,2.2+0,1.1=0,2+ 2a
Suy ra a= 0,2
Muối khan thu được là: 0,1.39+ 0,2.24+ 0,1.23+0,2.35,5+ 0,2.96= 37,3 gam

Quan sát 4 đáp án ta thấy
![]()
Vì dung dịch tồn tại 0,2 mol Mg2+ mà MgCO3 là chất kết tủa do đó Y sẽ là ![]() . Áp dụng định luật bảo toàn điện tích ta có
. Áp dụng định luật bảo toàn điện tích ta có
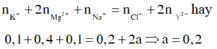
Khối lượng muối bằng tổng khối lượng của các ion trong dung dịch:
![]() gam
gam
Đáp án B.

Đáp án C
n Al 3+ + 2 n Fe 2+ + n Na+ = 2 n SO4 2- + n Cl-
=> 2a + b = 0.8 (1)
m muối = m Al 3++ m Fe 2+ + m Na+ + m SO4 2- + m Cl- = 51,6 g
=> 96 a + 35,5 b = 35 ,9 g (2)
Giải (1) và (2 ) ta có a = 0,3 , b = 0,2

Loại B, C vì CO32- tạo kết tủa với Mg2+. Như vậy Y2- là SO42-.
Bảo toàn điện tích → 0,3 + 0,6.2 + 0,3 = 0,6 + 2a → a = 0,6
→ m = 0,3.39 + 0,6.24 + 0,3.23 + 0,6.35,5 + 0,6.96 = 111,9
Đáp án C

Đáp án C
Bảo toàn điện tích:
0,12.1 + 0,05.1 = 0,12.1 + 2x
Þ x = 0,025
![]()
![]()
![]()
![]()
![]()
![]()
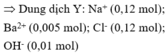
m = 0,12.23 + 0,005.137 + 0,12.35,5 + 0,01.17 = 7,875 (gam)

Chọn D
Bảo toàn điện tích có: 0,05 + 0,1.2 = 0,2 + 2x → x = 0,025.
mmuối = ∑mion = 0,05.23 + 0,1.24 + 0,2.35,5 + 0,025.96 = 13,05 (gam).

Đặt nP= x mol, nOH- =0,15 mol
TH1: Axit dư, x > 0,15
Dễ thấy chất rắn gồm
(x-0,15)/2 mol P2O5, 0,1 mol NaH2PO4, 0,05 mol KH2PO4
→mrắn= 142. (x-0,15)/2+ 99.0,1+ 136.0,05 > 8,56 gam (Vô lí)
TH2: Kiềm dư, x < 0,15/3= 0,05
Chất rắn gồm: x mol PO43-, 0,15-3x mol OH-, 0,1 mol Na+, 0,05 mol K+
→ mrắn= 95x+ 17. (0,15-3x)+ 23.0,1+ 39.0,05= 8,56 gam
→ x= 0,04
Vậy nP2O5= 0,02 mol→m= 2,84 gam
TH3: Tạo hỗn hợp muối, 0,05 < x< 0,15
Chất rắn gồm:
H2PO4-, HPO42-, PO43- (hai trong 3 gốc này): x mol; K+: 0,05 mol, Na+: 0,1 mol
→mrắn= M.x+ 23.0,1+ 39.0,05
Vì x> 0,05 và M> 95 nên mrắn > 95.0,05+ 2,3+1,95=9 >8,56
→Không thỏa mãn
Đáp án D
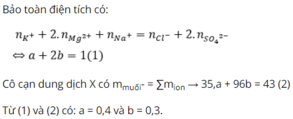


Đáp án D
BTĐT: nNO3- = nNa+ + 2nBa2+ + 2nMg2+ - nCl- = 0,3.1+0,1.2+0,05.2-0,2.1=0,4 mol
m muối = mNa+ + mBa2+ + mMg2+ + mCl- + mNO3- = 0,3.23+0,1.137+0,05.24+0,2.35,5+0,4.62 = 53,7 gam