Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH của các phản ứng :
2CO + O 2 → 2C O 2 (1)
3CO + O 3 → 3C O 2 (2)
Trong 1 mol hỗn hợp khí A có 0,6 mol O 3 và 0,4 mol O 2
Theo (1): 0,6 mol O 2 đốt cháy được 1,2 mol CO.
Theo (2) : 0,4 mol O 3 đốt cháy được 1,2 mol CO.
Kết luận : 1 mol hỗn hợp khí A đốt cháy được 2,4 mol khí CO.

Đặt x và y là số mol O 3 và O 2 có trong 1 mol hỗn hợp khí
Hỗn hợp khí A : (48x + 32y)/(x+y) = 19,2 x 2 = 38,4
→ 3x = 2y → 40% O 3 và 60% O 2
Đặt x và y là số mol H 2 và CO có trong 1 mol hỗn hợp khí
Hỗn hợp khí B : (2x + 28y)/(x+y) = 3,6 x 2 = 7,2
→ x = 4y → 80% H 2 và 20% CO

n O = 10.24%/16 = 0,15(mol)
Quy đổi X gồm n Fe = a(mol) ; n S = b(mol) ; n O = 0,15(mol)
=> 56a + 32b + 0,15.16 = 10(1)
n SO2 = 1,68/22,4 = 0,075(mol)
Bảo toàn electron :
3a + 6b = 0,15.2 + 0,075.2(2)
Từ (1)(2) suy ra a = 0,13 ; b = 0,01
Gọi n O2 = n O3 = x(mol)
Bảo toàn electron :
4n O2 + 6n O3 + 2n O = 3n Fe + 4n S
<=> 4x + 6x + 0,15.2 = 0,13.3 + 0,01.4
<=> x = 0,013
=> V = (0,013 + 0,013).22,4 = 0,5824 lít

Gọi số mol Al, Mg là a, b (mol)
=> 27a + 24b = 12,6 (1)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
a-->0,75a
2Mg + O2 --to--> 2MgO
b-->0,5b
=> 0,75a + 0,5b = 0,3 (2)
(1)(2) => a = 0,2 (mol); b = 0,3 (mol)
\(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{12,6}.100\%=42,86\%\\\%m_{Mg}=\dfrac{0,3.24}{12,6}.100\%=57,14\%\end{matrix}\right.\)
4Al (x mol) + 3O2 (0,75x mol) \(\underrightarrow{t^o}\) 2Al2O3.
2Mg (y mol) + O2 (0,5y mol) \(\underrightarrow{t^o}\) 2MgO.
Gọi x (mol) và y (mol) lần lượt là số mol của Al và Mg.
Số mol khí oxi cần dùng là 6,72:22,4=0,3 (mol)
Ta có: 27x+24y=12,6 (1).
Lại có: 0,75x+0,5y=0,3 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra x=0,2 (mol) và y=0,3 (mol).
%mAl=0,2.27/12,6\(\approx\)42,86%, %mMg=0,3.24/12,6\(\approx\)57,14%.

PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Ta có: \(n_{KMnO_4}=\dfrac{59,25}{158}=0,375\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=0,1875\left(mol\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{CO}=x\left(mol\right)\\n_{CO_2}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow x+y=\dfrac{6,72}{22,4}=0,3\left(1\right)\)
Các quá trình:
\(C^0\rightarrow C^{+2}+2e\)
x__________ 2x (mol)
\(C^0\rightarrow C^{+4}+4e\)
y__________ 4y (mol)
\(O_2^0+4e\rightarrow2O^{-2}\)
0,1875_0,75 (mol)
Theo ĐLBT mol e, có: 2x + 4y = 0,75 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,225\left(mol\right)\\y=0,075\left(mol\right)\end{matrix}\right.\)
Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,225}{0,3}100\%=75\%\text{ }\\\%V_{CO_2}=25\%\end{matrix}\right.\)
Bạn tham khảo nhé!

Zn + 2HCl => ZnCl2 + H2
Na2CO3 + 2HCl=> 2NaCl + H2O + CO2
MY = 0,5875.32 = 18,8
áp dụng sơ đồ đường chéo ta đc nH2 : nCO2 = 3:2
mà nH2 = nZn ; nCO2 = nNa2CO3
=> nZn = 3/2 nCO2
ta có \(65.\frac{3}{2}x+106x=4,07\left(g\right)\) => x= 0,02 mol => nZn =0,03
a. => % na2CO3 = \(\frac{0,02.106}{4,07}.100\%=52,088\%\)
=> % Zn = 47,912%
b. nHCl pư = 2 .nZn + 2. nNa2CO3 = 2.0,03+ 2.0,02 = 0,1
=> mHCl pư = 0,1.36,5 = 3,65 (g)
=> m HCl dùng = 3,65.120% = 4,38 (g)
=> mdd HCl = \(\frac{4,38.100}{25}=17,52\)
=> mdd = 4,07 + 17,52 - 0,03.2-0,02.44 = 20,65(g)
mHCl dư = 4,38 - 3,65 = 0,73(g)
C% HCl dư = \(\frac{0,73}{20,65}.100\%\) = 3,535%

Ở mỗi phần, Y gồm FeS(x mol), Fe dư(y mol)
Phần 2 :
n H2SO4 = 55.98%/98 = 0,55(mol)
n SO4(trong A) = n BaSO4 = 58,25/233 = 0,25(mol)
Gọi n SO2 = z(mol)
Bảo toàn electron : 9x + 3y = 2z(1)
Bảo toàn S : x + 0,55 = 0,25 + z(2)
Phần 1 :
$Fe + 2HCl \to FeCl_2 + H_2$
$FeS + 2HCl \to FeCl_2 + H_2S$
n H2 = n Fe = y(mol)
n H2S = n FeS = x(mol)
M Z = 13.2 = 26
Suy ra: 34x + 2y = 26(x + y) (3)
Từ (1)(2)(3) suy ra x = 0,075 ; y = 0,025 ; z = 0,375
Suy ra :
1/2 X có :
n Fe = 0,075 + 0,025 = 0,1(mol)
n S = 0,075(mol)
Vậy :
a = (0,1.56 + 0,075.32).2 = 16 gam

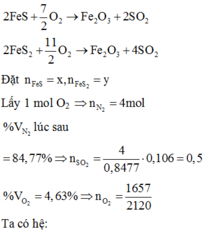
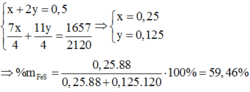
Phản ứng xảy ra:
\(C+O_2\underrightarrow{^{to}}CO_2\)
\(2H_2+O_2\rightarrow2H_2O\)
Ta có:
\(n_{CO2}=\frac{12,8}{16.2}=0,4\left(mol\right)=\frac{1}{2}n_{CO}+\frac{1}{2}n_{H2}\)
\(\Rightarrow n_{H2}=0,5\left(mol\right)\)
\(\Rightarrow m_{CO}=0,3.\left(12+16\right)=8,4;m_{H2}=0,5.2=1\left(g\right)\)
\(\Rightarrow\%m_{CO}=\frac{8,4}{8,4+1}=89,36\%\)
\(\Rightarrow\%m_{H2}=100\%-89,36\%=10,64\%\)