Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a, PT: \(4Na+O_2\underrightarrow{t^o}2Na_2O\)
______0,8___0,2___0,4 (mol)
b, a = mNa = 0,8.23 = 18,4 (g)
c, mNaOH = 0,4.40 = 16 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{16}{150}.100\%\approx10,67\%\)
Bạn tham khảo nhé!

\(n_{CaCO_3}=\dfrac{7,5}{100}=0,075\left(mol\right)\)
=> nC = 0,075 (mol)
Có \(n_{CO_2}=n_C=0,075\left(mol\right)\)
=> \(n_{H_2O}=\dfrac{4,2-0,075.44}{18}=0,05\left(mol\right)\)
=> nH = 0,1 (mol)
\(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn O: \(n_{O\left(A\right)}=0,075.2+0,05-0,1.2=0\left(mol\right)\)
=> A chứa C, H
mA = mC + mH = 0,075.12 + 0,1.1 = 1 (g)
\(m_{tăng}=m_{H_2O}+m_{CO_2}=4,2\left(g\right)\\ n_{CaCO_3}=\dfrac{7,5}{100}=0,075\left(mol\right)\)
PTHH: Ca(OH)2 + CO2 ---> CaCO3 + H2O
0,075 0,075
\(\rightarrow m_{CO_2}=0,075.44=3,3\left(g\right)\\ \rightarrow m_{H_2O}=4,2-3,3=0,9\left(g\right)\\ \rightarrow n_{H_2O}=\dfrac{0,9}{18}=0,05\left(mol\right)\\ \rightarrow n_{O\left(sau.pư\right)}=0,05+0,075.2=0,1\left(mol\right)\\ n_{O\left(trong.O_2\right)}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}n_C=0,075\left(mol\right)\\n_H=0,05.2=0,1\left(mol\right)\\n_O=0,1-0,1=0\left(mol\right)\end{matrix}\right.\)
=> mA = 0,075.12 + 0,1.1 + 0 = 1 (g)

CHÚC BẠN HỌC TỐT!!![]()
![]()
![]()
![]()
Theo đề bài, ta có: \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
pư...........0,2......0,2................0,2...........0,1 (mol)
a) \(C_{MddNaOH\left(A\right)}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
b+c) Ta có: \(n_{HCl\left(1M\right)}=0,5.1=0,5\left(mol\right)\)
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
pư............0,2..........0,2............0,2..........0,2 (mol)
Ta có tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,5}{1}\) Vậy HCl dư, NaOH hết.
\(\Rightarrow m_{NaCl\left(ddB\right)}=58,5.0,2=11,7\left(g\right)\)
Tính nồng độ MOL các chất có trong dd B :3 giúp mình với

\(n_{Na}=\dfrac{4,6}{23}=0,2mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,2 0,2 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{NaOH}=0,2\cdot40=8g\)
\(m_{ddNaOH}=4,6+0,2\cdot18-0,1\cdot2=8g\)
\(\Rightarrow C\%=\dfrac{m_{NaOH}}{m_{ddNaOH}}\cdot100\%=\dfrac{8}{8}\cdot100\%=100\%???\)
Sửa đề: Tính nồng độ mol của dung dịch NaOH???
\(C_{M_{NaOH}}=\dfrac{0,2}{0,3}=\dfrac{2}{3}M\)

Đốt cháy hoàn toàn 4,6g Natri rồi lấy sản phẩm cho vào 120g dd NaOH 25% thu được dd X. Tính C% dd X
--
nNa= 0,2(mol)
mNaOH= 120.25%= 30(g) -> nNaOH= 0,75(mol)
PTHH: Na + H2O -> NaOH +1/2 H2 (1)
nNaOH (1)= nNa= 0,2(mol)
=> nNaOH= 0,2+0,75=0,95(mol)
mNaOH= 0,95.40= 38(g)
mddNaOH(sau)= 120+4,6-0,1.2= 124,4(g)
=> \(C\%ddNaOH\left(sau\right)=\frac{38}{124,4}.100\approx30,547\%\)

Bài 1: PTHH: Na2O + H2O → 2NaOH
Số mol của Na2O là: 12,4 : 62 = 0,2 mol
100 gam nước tương ứng với 100 ml nước = 0,1 lít
a) Số mol của NaOH là: 0,2 . 2 = 0,4 mol
Khối lượng chất tan NaOH là: 0,4 . 40 = 16 gam
Áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch NaOH sau phản ứng là: 112,4 gam
C% dd sau pứ là: (16 : 112,4 ) . 100% = 14,235%
b) CM của dung dịch sau phản ứng là:
0,4 : 0,1 = 4M

PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
\(Na_2O+H_2O\rightarrow2NaOH\)
Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=n_{Na}+2n_{Na_2O}=\dfrac{4,6}{23}+2\cdot\dfrac{6,2}{62}=0,3\left(mol\right)\\n_{H_2}=\dfrac{1}{2}n_{Na}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{NaOH}=0,3\cdot40=12\left(g\right)\\m_{H_2}=0,05\cdot2=0,1\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(sau.p/ứ\right)}=m_{Na}+m_{Na_2O}+m_{H_2O}-m_{H_2}=110,7\left(g\right)\)
\(\Rightarrow C\%_{NaOH}=\dfrac{12}{110,7}\cdot100\%\approx10,84\%\)

\(n_{Al} = a\ ; n_{Fe} =b\\ \Rightarrow 27a + 56b = 11(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{8,96}{22,4} = 0,4(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,1\\ n_{HCl\ dư} = \dfrac{200.21,9\%}{36,5} - 0,2.3 - 0,1.2 = 0,4(mol)\\ m_{dd\ sau\ pư} = 11 + 200 - 0,4.2 = 210,2(gam)\\ C\%_{HCl} = \dfrac{0,4.36,5}{210,2}.100\% = 6,95\%\\ \)
\(C\%_{AlCl_3} = \dfrac{0,2.133,5}{210,2}.100\% = 12,7\%\\ C\%_{FeCl_2} = \dfrac{0,1.127}{210,2}.100\% = 6,04\%\)
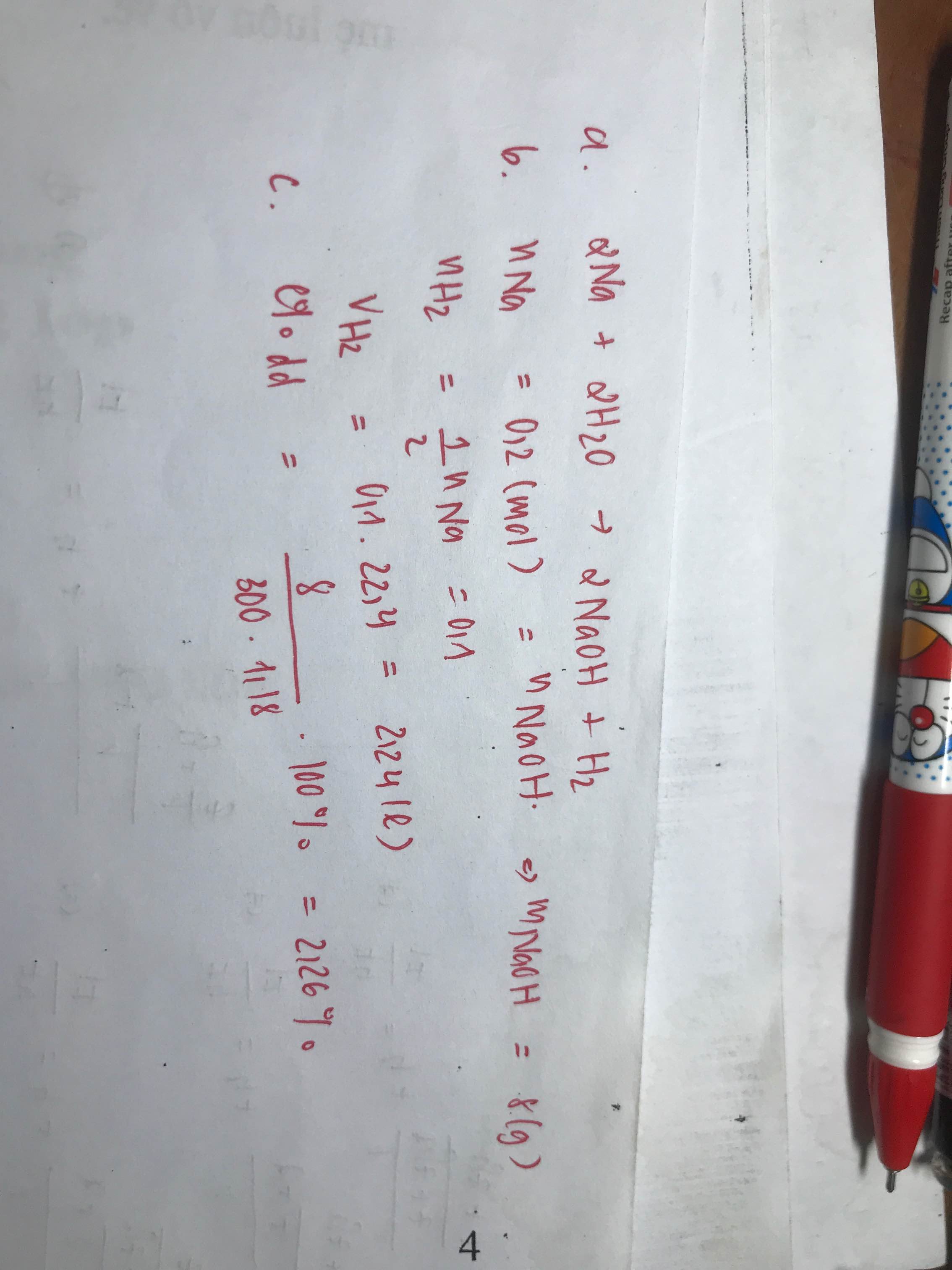

nNa = 4,6 / 23 = 0,2 (mol)
Na + 2H2O -- > NaOH + H2
mH2 = 0,2.2 =0,4 (g)
dd = mNa + mddH2O - mH2 = 4,6 + 200 - 0,4 = 204,2(g)
mNaOH = 0,2 . 40 = 8(g)
=> \(C\%_{ddA}=\dfrac{8.100}{204,2}=3,9\%\)