Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A
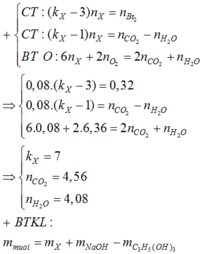
= 4 , 56 . 12 + 4 , 08 . 2 + 0 , 08 . 6 . 16 + 0 , 08 . 3 . 40 - 0 , 08 . 92
= 72 , 8 g a m

Ta có nBr2 : nX = 0,32 : 0,08 = 4 nên các gốc hiđrocacbon của chất béo có tổng cộng 4π
Mà mỗi gốc COO có 1π nên độ bất bão hòa của toàn phân tử X là k = 4 + 3 = 7
- Phản ứng đốt 0,08 mol X:
Giả sử nCO2 = a và nH2O = b (mol)
+) Bảo toàn O → 6nX + 2nO2 = 2nCO2 + nH2O
→ 2a + b = 6.0,08 + 2.6,36 (1)
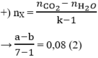
Giải (1) (2) được a = 4,56 và b = 4,08
BTKL → mX = mCO2 + mH2O - mO2 = 4,56.44 + 4,08.18 - 6,36.32 = 70,56 gam
Ta có X + 3NaOH → Muối + C3H5(OH)3
0,08 → 0,24 → 0,08 (mol)
BTKL → mmuối = mX + mNaOH - mC3H5(OH)3
= 70,56 + 0,24.40 - 0,08.92 = 72,8 gam
Đáp án cần chọn là: A

BTKL → mCO2 = mX + mO2 - mH2O = 11a - 121b
→ nCO2 = 2,5x - 2,75y (mol)
Bảo toàn O → nO(trong X) = 2nCO2 + nH2O - 2nO2 = 3x - 4,5y (mol)
X có 6O → nX = 1/6.nO(trong X) = 0,5x - 0,75y (mol)
Khi đốt hợp chất hữu cơ chứa C, H, O thì:
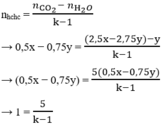
→ k = 6
=> X có chứa 6 liên kết π, mà có 3 π trong 3 nhóm COO
→ còn lại 3 π ngoài gốc hiđrocacbon
- Khi X phản ứng với Br2 thì X + 3Br2 → Sản phẩm cộng
→ nX = 1/3.nBr2 = 1/3.0,15 = 0,05 mol = a
Đáp án cần chọn là: A

Coi E gồm :
$HCOOH : a(mol)$
$(HCOO)_3C_3H_5 : b(mol)$
$CH_2 : c(mol)$
$H_2 : -0,2(mol)$
Ta có :
$46a + 176b + 14c - 0,2.2 = 52,24(1)$
Bảo toàn electron : $2a + 20b + 6c - 0,2.2 = 4,72.4(2)$
$n_{NaOH} = a + 3b = 0,18(3)$
Từ (1)(2)(3) suy ra a = 0,06 ; b = 0,04 ; c = 3,06
$n_{NaOH\ đã\ dùng} = 0,18 + 0,18.15\% = 0,207(mol)$
$n_{H_2O} = a = 0,06(mol)$
Bảo toàn khối lượng :
$m = 52,24 + 0,207.40 - 0,06.18 - 0,04.92 = 55,76(gam)$
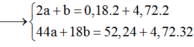
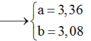
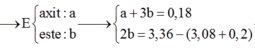
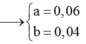
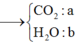
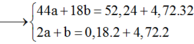
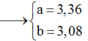
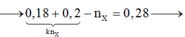
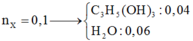


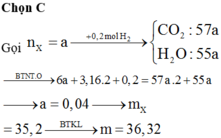
Đáp án A
X cháy